Lehre - Supramolekulare Chemie - Selbstaggregation
Einleitung
Natürliche selbstaggregierende Systeme
Ein natürliches selbstaggregierendes System ist das Tabakmosaikvirus. Es handelt sich dabei um ein stabförmiges Virus mit einer Länge von 3000 Å und einem Durchmesser von 180 Å. Es besteht aus 2130 identische Proteinuntereinheiten (MW 17500), die in einer rechtshändigen helikalen Anordnung einen RNA-Strang mit einer Länge von 6390 Nucleinsäureuntereinheiten umgeben.

[Quelle: Stryer, K. Biochemie, 4. Aufl. Spektrum Akademischer Verlag, 1996, S. 94.]
Synthetische selbstaggregierende Systeme
Eine programmierte Synthese komplexer Aggregate gelingt bei Verwendung von Untereinheiten definierter Geometrie und Anzahl funktioneller Gruppen, welche durch gerichtete nicht-kovalente oder koordinative Wechselwirkungen aneinander binden.
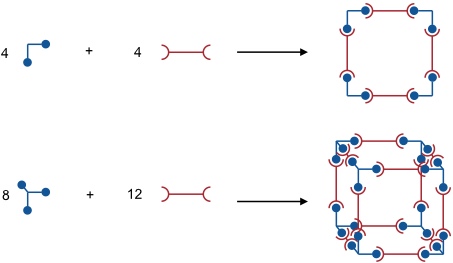
Die Bildung der hochgeordneten Produkte wird durch ein Zusammenspiel enthalpischer und entropischer Faktoren kontrolliert. Enthalpisch sind alle Strukturen günstig, die spannungsfrei sind und bei denen keine freien Koordinationsstellen verbleiben. Aus der Serie der der unter diesem Aspekt denkbaren Produkte sind entropisch diejenigen mit dem kleinsten Molekulargewicht bevorzugt, da hiervon die größte Anzahl gebildet werden kann.
Wasserstoffbrücken
EinHeitung
Der Prototyp eines natürlichen selbstaggregierenden Systems, das u.a. durch Wasserstoffbrücken stabilisiert wird, ist die DNA Doppelhelix.
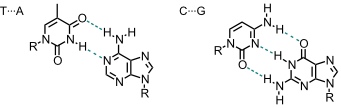
Zu einer wirksamen Wechselwirkung kommt es, wenn sich ein Wasserstoffbrückendonor (z.B. N–H) und ein Wasserstoffbrückenakzeptor (z.B. N oder O) gegenüberliegen. Dabei hängt die Stabilität der Aggregate von der Anzahl der Wasserstoffbrücken ab. Darüber hinaus spielen sekundäre Wechselwirkungen eine Rolle. Diese führen z.B. dazu, dass erheblich stabilere Aggregate zwischen Verbindungen gebildet werden, in denen ein Bindungspartner nur Wasserstoffbrückenakzeptoren enthält und der andere nur Wasserstoffbrückendonoren als zwischen Verbindungen, die sowohl Wasserstoffbrückenakzeptoren als auch -donoren enthalten.
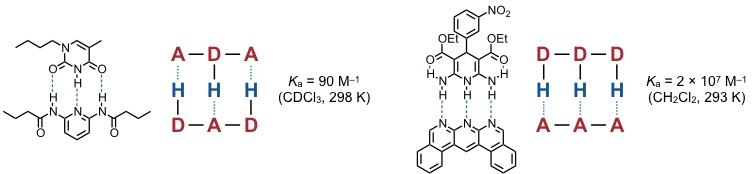
[Quelle: Djurdjevic, S.; Leigh, D: A.; McNab, H.; Parsons, S.; Teobaldi, G.; Zerbetto, F. J. Am. Chem. Soc. 2007, 129, 476-477: <doi>.]
Rosetten
Die einfachsten heterocyclischen Systeme, die durch Bildung eines definierten Musters von Wasserstoffbrücken selbstaggregieren, sind Cyanursäure und Melamin.
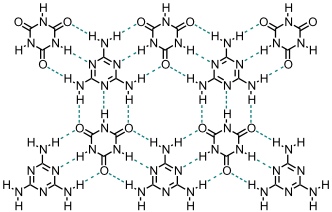
Vereinfacht man die beiden Verbindungen strukturell und verhindert dadurch die Bildung dreidimensionaler Netzwerke, so kann man niedermolekulare Aggregate erhalten.
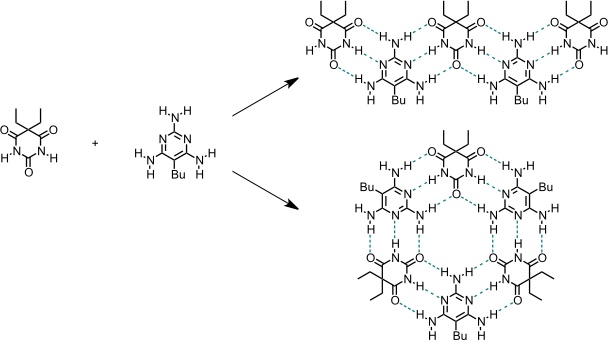
Es hängt von Lösungsmittel und von anderen Faktoren ab, welche Struktur bevorzugt wird. Bei Verwendung von Heterocyclen der unten dargestellten Struktur ist nur eine lineare Anordnung möglich.
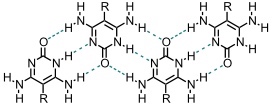
U.a. sind im Arbeitskreis um J.-M. Lehn weitere heterocyclische Verbindungen synthetisiert worden, die über Wasserstoffbrücken aggregieren. Lehn nennt diese Moleküle Janus-Moleküle (vom griechischen Gott Janus, der zwei Gesichter hat), da sie an beiden Seiten des Moleküls Wasserstoffbrückenakzeptoren und -donoren besitzen.
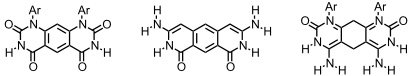
Die cyclische Anordnung der Barbitursäure und Pyrimidinringe wird auch als Rosette bezeichnet. Mit der gezielten Darstellung solcher Aggregate haben sich vor allem die Gruppen um G. M. Whitesides und D. N. Reinhoudt beschäftigt.
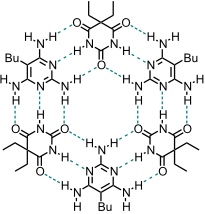
Ein rosettenförmiges Aggregat aus Barbitursäure und Pyrimidin besteht aus sechs Molekülen und wird über 18 Wasserstoffbrücken stabilisiert. Aus entropischen Gründen ist die Selbstaggregation ungünstig. Durch Anwendung von zwei grundlegenden Prinzipien kann man aber die Bildung einer Rosette erreichen.
Präorganisation: Drei identische Komponenten der Rosette werden kovalent verknüpft, was bei geeigneter Wahl der Spacer zu einer Präorganisation führt. Außerdem wird der entropische Term bei der Selbstaggregation günstiger, da nur noch 1+3 Moleküle aggregieren.
Gruppenhäufung: Durch Einführung großer Substituenten in der Peripherie der Rosette wird die Bildung linearer Aggregate benachteiligt.
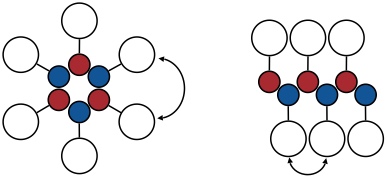
Auf diese Weise konnten verschiedene Rosettenarchitekturen realisiert werden.
Monorosetten
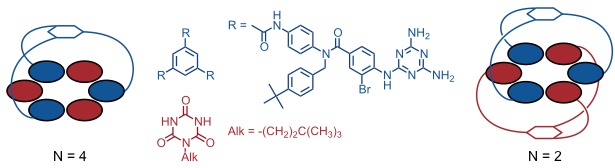
Bis(rosetten)
Bis(rosetten)
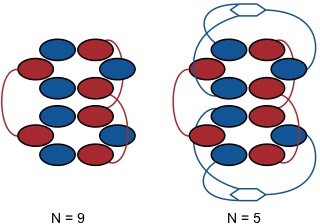
In der Gruppe um D. N. Reinhoudt wurden Bis(rosetten) entwickelt, die durch Selbstaggregation von Calix[4]arenen mit Melaminsubstituenten und Barbitursäurederivaten entstehen.
Bei diesem System lagern sich drei Calixarene und sechs Barbiturate zusammen, sodass ein Aggregat aus insgesamt neun Komponenten, stabilisiert durch 36 Wasserstoffbrücken entsteht.
Kristallstruktur der Bis(rosette)
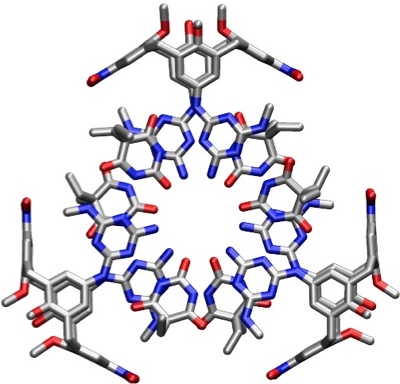
[Für eine interaktive Version der Kristallstruktur hier klicken]
[Quelle: Timmerman, P.; Vreekamp, R. H.; Hulst, R.; Verboom, W.; Reinhoudt, D. N.; Rissanen, K.; Udachin, K. A.; Ripmeester, J. Chem. Eur. J. 1997, 3, 1823-1832: <doi>.]
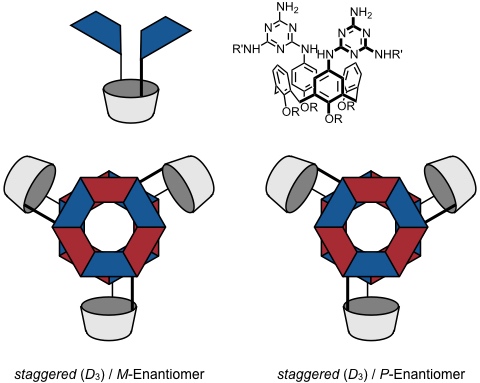
Bei diesem System können, in Abhängigkeit der Konformation der Calixarenkomponente vier stereoisomere Aggregate entstehen.
Staggered
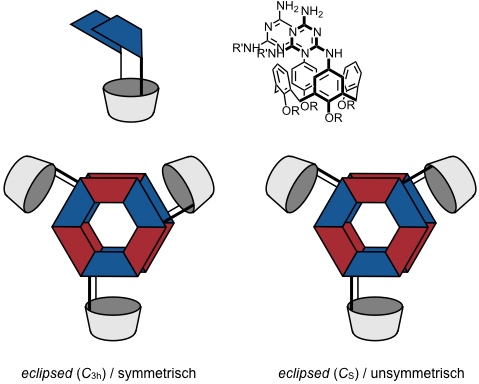
Eclipsed
Diethylbarbiturate führen bevorzugt zur Bildung des Racemats der Rosetten mit dem staggered Calix[4]aren Konformer. In anderen Fällen ist die Situation komplizierter.
So wird die Rosette mit einer eclipsed Anordnung der einzelnen Komponenten durch sterische Wechselwirkung von Substituenten an den Barbitursäureuntereinheiten stärker benachteiligt, als die Rosette mit der der staggered Anordnung.
Eine elegante Methode zur Postfunktionalisierung solcher Rosetten beruht auf dem sogenannten covalent capture. Enthalten die Melamineinheiten Reste mit terminalen Doppelbindungen (R' = -(CH2)6CH=CH2), so kann man die einzelnen Einheiten durch Olefin-Metathese miteinander verknüpfen. Aus strukturellen Gründen bildet sich aus Bisrosetten mit der gestaffelten Anordnung der Einzelrosetten nach Abspaltung der verbrückenden Barbitursäureeinheiten ein Makrocyclus mit drei Calixareneinheiten. Die intramolekulare Verknüpfung der Kettenenden, die zu drei isolieren Calixarenderivaten führt, wird nicht beobachtet.
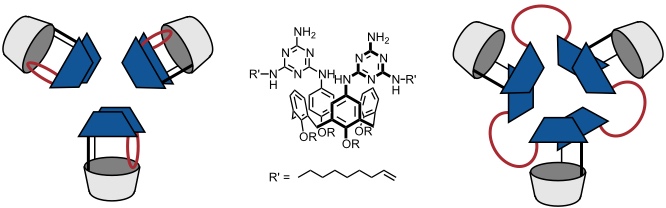
Tragen die Melamineinheiten chirale Substituenten R', so kann die Selbstaggregation zur enantioselektiven Bildung einer chiralen Rosette mit P- oder M-Anordnung der Calixarenuntereinheiten führen.
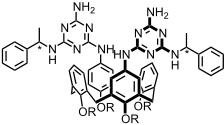
Interessanterweise können die chiralen Bausteine in diesen Aggregaten sukzessive gegen nicht-chirale Komponenten ausgetauscht werden, ohne dass die übergeordnete Chiralität der Rosette verloren geht. Dieser Effekt wird als chiral memory bezeichnet.
Auch die Wirt-Gast-Chemie solcher Bis(rosetten) wurde in der Reinhoudt-Gruppe untersucht. So wurde eine Interkalation von Gastmolekülen mit ausgedehnten π-Systemen (Anthracenderivate) zwischen die beiden Rosetten beobachtet.
Kapseln
Zur Synthese von selbstaggregierenden Systemen, die bei der Aggregation einen Hohlraum definierter Größe umgeben, kann man:
- zwei halbschalenförmige Untereinheiten über Wasserstoffbrücken zu einer Kapsel zusammenfügen,
- Untereinheiten verwenden, die neben Wasserstoffbrückenakzeptoren und -donoren eine charakteristische konkave Gestalt besitzen. Dadurch ist gewährleistet, dass eine Aggregation unter Ausnutzung der maximal möglichen Anzahl von Wasserstoffbrücken zur Bildung eines mehr oder weniger sphärischen Komplexes führt.
Ausgehend von Glycoluril wurde in der Gruppe von J. Rebek eine molekulare Kapsel entwickelt, die aus zwei miteinander wechselwirkenden Molekülen des Glycolurilderivats besteht. Glycoluril besitzt eine gekrümmte Form. Bei Aggregation zweier identischer Moleküle über Wasserstoffbrücken entsteht eine sphärische Kapsel, an deren Saum, welche der Naht in einem Tennisball folgt, 8 Wasserstoffbrücken für eine Stabilisierung sorgen.
Tennisball
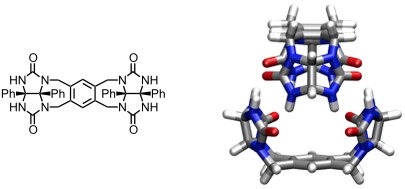
[Für eine interaktive Version der Kristallstruktur hier klicken]
Das innere Volumen dieser Kapsel beträgt 50-55 Å3. Dadurch können nur kleine Gäste, wie Methan, Xenon oder Lösungsmittelmoleküle, aufgenommen werden. In polaren Lösungsmitteln ist die Kapsel nicht stabil und dissoziiert in die Untereinheiten.
Ausgehend von einem ausgedehnteren Bis(glycoluril) kann eine Kapsel mit vergrößerter Kavität aufgebaut werden. Dieser sogenannte Softball wird durch Wasserstoffbrücken zwischen den Glycourilresten und zwischen den Amid Carbonylgruppen und den OH-Gruppen stabilisiert. Der Hohlraum ist immerhin so groß, dass ein Adamantanmolekül eingelagert werden kann.
Softball
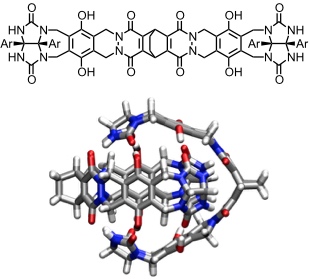
[Für eine interaktive Version der Kristallstruktur hier klicken]
Interessanterweise kann der Softball auch als Reaktionskammer eingesetzt werden.
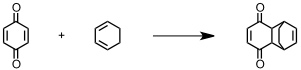
Donut
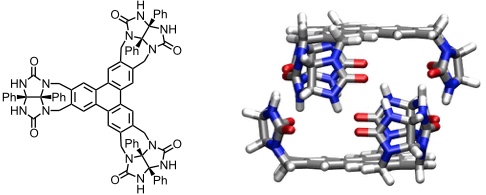
[Für eine interaktive Version der Kristallstruktur hier klicken]
Football
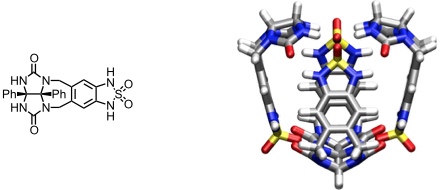
[Für eine interaktive Version der Kristallstruktur hier klicken]
Calix[4]aren Kapsel
Die zweite Strategie zur Synthese von Kapseln basiert auf der Aggregation von geeigneten makrocyclischen Untereinheiten. Dimere und hexamere Aggregate von Resorcinarenen wurden bereits vorgestellt. Diese sind allerdings oft häufig nur im Kristall stabil. Eine stabile Kapsel bildet sich in organischen, nicht-kompetitiven Lösungsmitteln bei Aggregation von zwei Calix[4]arenmolekülen, die an geeigneten Positionen Harnstoffsubstituenten tragen.
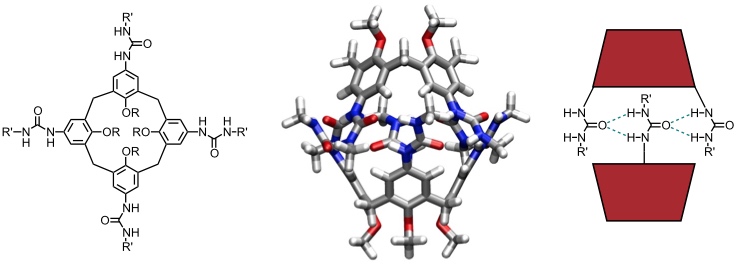
[Für eine interaktive Version der Kristallstruktur hier klicken]
Der Hohlraum zwischen den beiden Calixarenmolekülen ist groß genug für den Einschluss einfacher alicyclischer oder aromatischer Moleküle bzw. von bi- oder tricyclischen Verbindungen.
Von der Gruppe um V. Böhmer konnte auf Basis dieser Kapseln eine Synthese von Bis[2]catenanen realisiert werden. Ähnlich wie bei den Rosetten von Reinhoudt basiert diese Synthese ebenfalls auf der intermolekularen Verknüpfung der beiden Calixareneinheiten einer Kapsel durch Olefin-Metathese.
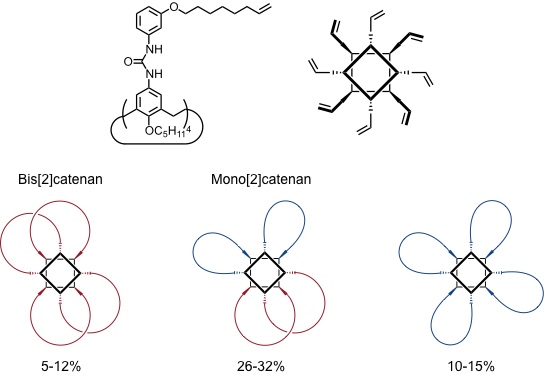
[Quelle: Vysotsky, M. O.; Bolte, M.; Thondorf, I.; Böhmer, V. Chem. Eur. J. 2003, 9, 3375-3382: <doi>.]
Aus dieser ersten statistischen Bis[2]catenansynthese wurde in der Folge eine gezielte Variante entwickelt.
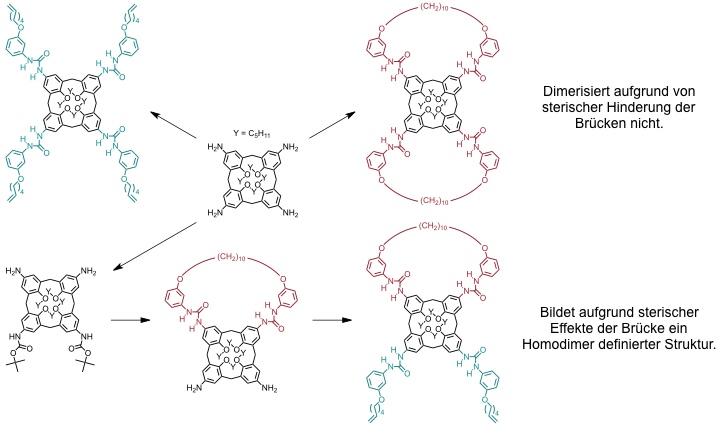
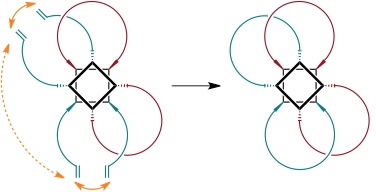
Ausbeute des Bis[2]catenans bis zu 50% wenn beide Ringschlüsse gleich wahrscheinlich sind. Experimentell: 49%.
(Beachte, dass in diesem Fall eine Decylkette gebildet wird aber bei dem statistischen Verfahren aufgrund des anderen Substituenten eine Tetradecylkette. Unter den für die statistische Synthese verwendeten Bedingungen wird aus dem tetrafunktionalisieren Calixaren mit den kürzeren Ketten kein Bis[2]catenan gebildet.)
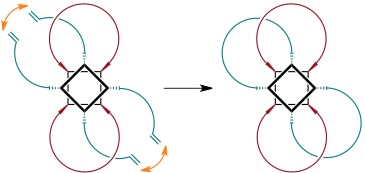
Ausbeute des Bis[2]catenans bis zu 100%, da nur ein Ringschluss möglich. Experimentell: 65%.
(Die Verknüpfung der jeweils anderen möglichen Paare von Olefinen führt zu dem enantiomeren Bis[2]catenan.)
[Quelle: Bogdan, A.; Vysotsky, M. O.; Ikai, T.; Okamoto, Y.; Böhmer, V. Chem. Eur. J. 2004, 10, 3324-3330: <doi>.]
Cavitand Kapsel
Die größte dimere Kapsel, die in Lösung stabil ist, wurde wiederum von der Gruppe um J. Rebek Jr. beschrieben. Sie basiert auf den in derselben Gruppe entwickelten vertieften Cavitanden. Diese Verbindungen aggregieren unter Bildung einer vasenförmigen Kapsel, die durch 16 Wasserstoffbrücken stabilisiert wird.
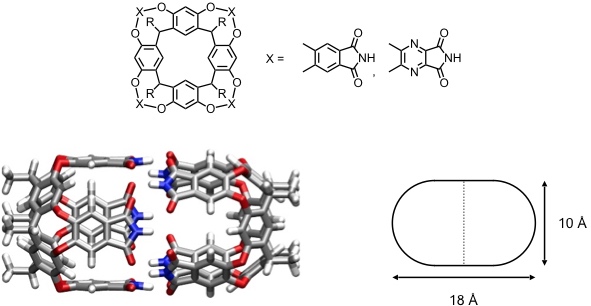
[Für eine interaktive Version der Kristallstruktur hier klicken]
Diese Kapsel hat einen so großen Hohlraum, dass zwei Aromaten eingelagert werden können. Optimal wird der Hohlraum z.B. von einem Molekül Benzol und einem Molekül p- Xylol ausgefüllt. Auch zwei Picolinmoleküle können in den Hohlraum eingelagert werden.
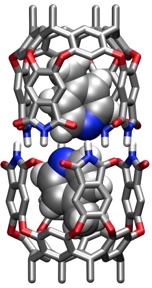
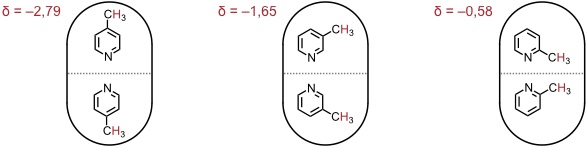
Die chemischen Verschiebungen der Signale der Methylgruppe von α-, β- und γ-Picolin in einer Kapsel mit zwei identischen Gastmolekülen zeigt, dass die Gäste bevorzugt mit dem Ringstickstoff in der Nähe des Kapseläquators angeordnet sind. Sie können entlang der Moleküllängsachse rotieren. Ein Platztausch ist aber nicht möglich. In Anwesenheit verschiedener Picolinisomere in Lösung beobachtet man auch die Bildung von Kapseln mit zwei unterschiedlichen Gastmolekülen.
Diese Kapsel bindet darüber hinaus Alkane. Dabei beobachtet man, dass Undecan (C11H24) in der thermodynamisch günstigsten zick-zack Konformation am besten in den Hohlraum der Kapsel passt und dementsprechend den stabilsten Komplex bildet. Kürzere Alkane bilden aufgrund verringerter hydrophober Kontakte mit der inneren Kapseloberfläche (Dispersionswechselwirkungen) weniger stabile Komplexe. Bis zu Tetradecan werden auch längere Alkane gebunden, welche aber für die Komplexbildung Konformationen mit thermodynamisch ungünstigen gauche Anordnungen annehmen müssen. Der dafür notwendige Energiebetrag verringert die Komplexstabilität, kann aber teilweise durch Wechselwirkung der helikalen Gäste mit der inneren Kapseloberfläche kompensiert werden.
| Gast | Krel in d12-Mesitylen | Anzahl gauche Anordnungen |
| n-C9H20 | 0,3 | 0 |
| n-C10H22 | 16,9 | 0 |
| n-C11H24 | 100 | 0 |
| n-C12H26 | 24,4 | 4 |
| n-C13H28 | 1,0 | 8 |
| n-C14H30 | 0,008 | 11 |
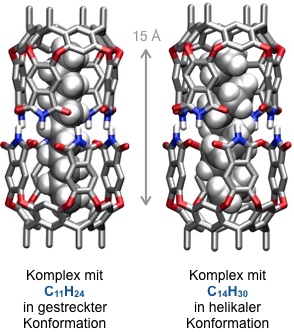
Länge C14H30 in gestreckter Konformation 20,0 Å
Länge C14H30 in helikaler Konformation 15,5 Å
Helikale Konformationen eigelagerter Alkane wirken wie eine kontrahierte Feder und üben auf die Kapsel einen inneren Druck auf. Dieser Druck kann durch Zugabe von Glycoluril zu Lösungen der entsprechenden Komplexe abgebaut werden, indem sich vier Glycolurileinheiten zwischen zwei Cavitandmoleküle einlagern.
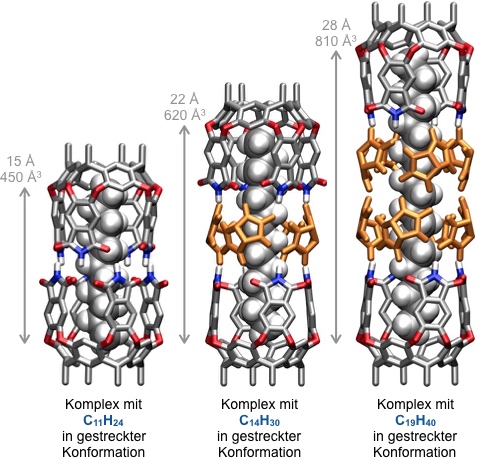
Ein einziger Gürtel von Glycolurileinheiten führt die einer Vergrößerung der Kapselausdehnung, die die Einlagerung von Tetradecan in gestreckter Form in den Hohlraum erlaubt. Längere Alkane nehmen bei Einlagerung teilweise wieder gauche Anordnungen an.
Entsprechend induzieren diese Alkane die Bildung noch höherer Aggregate mit 8 oder sogar 12 Glycolurileinheiten zwischen den Kapselhälften, um in der thermodynamisch günstigsten zick- zack Anordnung eingelagert werden zu können.
[Quelle: Ajami, D.; Rebek Jr., J. Angew. Chem. 2007, 119, 9443-9446: <doi>.]
Röhren
Röhren entstehen, wenn makrocyclische Verbindungen über Wasserstoffbrücken miteinander wechselwirken, welche parallel zur Hauptdrehachse des Makrocyclus orientiert sind. Ein gut untersuchtes Beispiel sind cyclische Peptide, die aus einer geraden Anzahl von Untereinheiten bestehen und in alternierender Sequenz aus D- und L-Aminosäuren aufgebaut sind. Die selbstaggregierenden Eigenschaften dieser Verbindungen wurden maßgeblich im Arbeitskreis um M. R. Ghadiri studiert.
Der Ring dieser Cyclopeptide kann eine planare Konformation annehmen, in der die Peptidgruppen senkrecht zur Ringebene ausgerichtet sind. Dadurch können sich oberhalb und unterhalb eines Ringes weitere Cyclopeptide anlagern, wobei die Wechselwirkung der Cyclopeptide untereinander dem Wasserstoffbrückenmuster in einem antiparallelen β-Faltblatt entspricht.
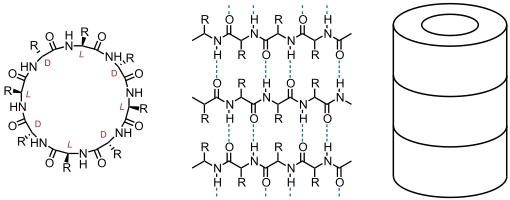
Solche Röhren besitzen einen nach beiden Seiten geöffneten Hohlraum. Diesen können Gäste passieren und dadurch z.B. durch eine Membran transportiert werden. Der Durchmesser der Röhre aus einem Octapeptid beträgt ca. 7 Å. Ein Dodecapeptid bildet eine Röhre mit einem Durchmesser von 13 Å.
Die Röhre eines cyclisches Peptids mit der Struktur cyclo[(L-Trp-D-Leu)4-L-Glu-D-Leu] wurde in eine Membran eingelagert. Dabei wird die Länge der Röhre durch die Dicke der Doppelschicht kontrolliert. Dieses Peptid ist groß genug, um den Transport von Glucose durch die Membran zu ermöglichen. Mit Peptidröhren, die einen kleineren Innendurchmesser besitzen, wurde kein Transport beobachtet.
In Lösung konnte die Selbstaggregation der Cyclopeptide u.a. nachgewiesen werden, indem man Derivate verwendete, welche an jeder zweiten Aminosäure N-methyliert waren. Auf diese Weise wurde verhindert, dass das Cyclopeptid Wasserstoffbrücken in beide Richtungen bilden kann, wodurch die Selbstaggregation auf die Bildung eines Dimers beschränkt ist.
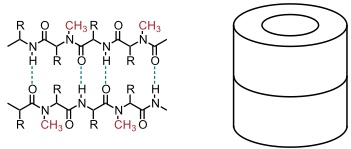
Dieses Aggregat konnte durch kovalente Verknüpfung der Seitenketten von jeweils gegenüberliegenden Aminosäureuntereinheiten stabilisiert werden (covalent capture).
Peptidnanoröhren können nicht nur auf Basis von Cyclopeptiden mit α-Aminosäuren erhalten werden. Daneben bilden auch Cyclopeptide mit β-Aminosäuren Nanoröhren oder Cyclopeptide mit alternierenden α- und γ-Aminosäuren oder mit cyclischen Harnstoffen.
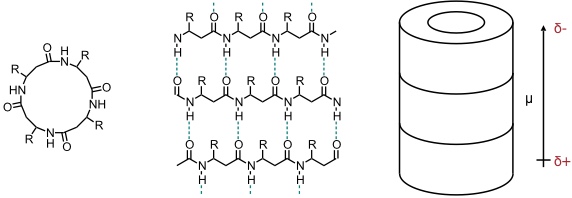
Röhren aus aggregierenden β-Peptiden besitzen im Gegensatz zu solchen mit α-Aminosäureuntereinheiten ein Dipolmoment entlang der Helixachse. Diese Eigenschaft könnte für gerichtete Transportprozesse besonders interessant sein.
Literatur
- Whitesides, G. M.; Simanek, E. E.; Mathias, J. P.; Seto, C. T.; Chin, D. N.; Mammen, M.; Gordon, D. M. "Non-covalent Synthesis Using Physical-Organic Chemistry to Make Aggregates" Acc. Chem. Res. 1995, 28, 37-44: <doi>.
- Conn, M. M. ; Rebek Jr., J. "Self-Assembling Capsules" Chem. Rev. 1997, 97, 1647-1668: <doi>.
- Prins, L. J.; Timmerman, P.; Reinhoudt, D. N. "Non-covalent Synthesis of Organic Nanostructures" Pure Appl. Chem. 1998, 70, 1459-1468: <doi>.
- Rebek Jr., J. "Host-Guest Chemistry of Calixarene Capsules" Chem. Commun. 2000, 637-638: <doi>
- Bong, T. D.; Clark, T. D.; Granja, J. R.; Ghadiri, M. R. "Organische Nanoröhren durch Selbstorganisation" Angew. Chem. 2001, 113, 1016-1041: <doi>.
- Prins, L. J.; Reinhoudt, D. N.; Timmerman, P. "Nicht-kovalente Synthese mit Wasserstoffbrücken" Angew. Chem. 2001, 113, 2446-2492: <doi>.
- Hof, F.; Craig, S. L.; Nuckolls, C.; Rebek Jr., J. "Molekulare Verkapselung" Angew. Chem. 2002, 114, 1556-1578: <doi>.
- Rebek Jr., J. "Simultane Verkapselung: Moleküle unter sich" Angew. Chem., 2005, 117, 2104-2115: <doi>.
- Bogdan, A.; Rudzevich, Y.; Vysotsky, M. O.; Böhmer, V. "Topologically Novel Multiple Rotaxanes and Catenanes Based on Tetraurea Calix[4]arenes" Chem. Commun. 2006, 2941-2952: <doi>.
- Rebek Jr., J. "Contortions of Encapsulated Alkyl Groups" Chem. Commun. 2007, 2777-2789: <doi>.
- Mandal, D.; Shirazi, A. N.; Parang, K. "Self-Assembly of Peptides to Nanostructures" Org. Biomol. Chem. 2014, 12, 3544-3561: <doi>.
- Ajami, D.; Liu, L.; Rebek Jr., J. "Soft Templates in Ecapsulation Complexes" Chem. Soc. Rev. 2015, 44, 490-499: <doi>.
Metallkoordination
Einleitung
Eine wichtige Methode zum Aufbau komplexerer Molekülarchitekturen durch Selbstaggregation beruht auf der Nutzung koordinativer Wechselwirkungen. Der Vorteil dieser Strategie ist die Reversibilität vieler koordinativer Bindungen. Dadurch erfolgt die Selbstaggregation geeigneter Untereinheiten unter thermodynamischer Kontrolle und führt zum thermodynamisch stabilsten Produkt.
Koordinative Wechselwirkungen zählen allerdings nicht zu den nicht-kovalenten Wechselwirkungen. Verbindungen, die durch Metallkoordination stabilisiert werden, sind also keine supramolekularen Systeme im engeren Sinne. Dennoch wird das Gebiet des Aufbaus höhermolekularer Strukturen durch vorhersagbare Aggregation strukturell definierter Untereinheiten über Metall-Ligand-Wechselwirkungen zur supramolekularen Chemie gezählt. Nicht jeder Metallkomplex ist aber gleichzeitig ein supramolekulares Aggregat.
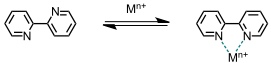
Durch Metallkoordination konnten verschiedene ungewöhnliche Strukturen realisiert werden. Häufig basiert der Aufbau solcher Komplexe auf der koordinativen Wechselwirkung von stickstoffhaltigen Heterocyclen, z.B. Bipyridin, an geeignete Metalle.
Doppelhelices
Oligomere mit 2,2'-Bipyridyluntereinheiten bilden in Anwesenheit von Cu+ doppelhelikale Komplexe.
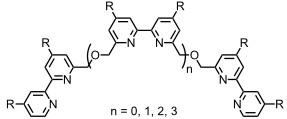
In Abhängigkeit von der Länge der Oligomere werden Di-, Tri-, Tetra- bzw. Pentahelikate gebildet. Dabei entstehen auch in Anwesenheit verschiedener Oligomere nur strukturell einheitliche Komplexe und keinerlei ungeordnete, polymere Spezies.
Die Bildung der Helikate ist ein kooperativer Prozess. Dabei erleichtert die Bindung des ersten Metallions die des zweiten usw. Da die einzelnen Bausteine achiral sind, bilden sich rechts- und linksgängige Helices in gleichen Mengen.
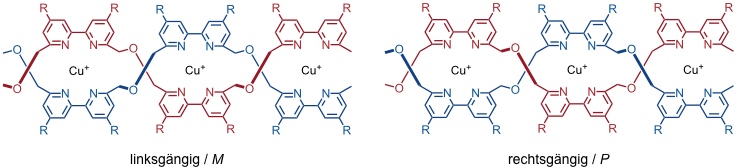
Diese Helikate kann man an den Oberflächen durch Einführung von Substituenten modifizieren. So können sie mit Nucleobasen versehen werden, welche - im Gegensatz zur DNA - divergieren. Eine Wechselwirkung dieser Helikate mit Nucleinsäuren konnte nachgewiesen werden.
Setzt man chirale Bausteine ein, so findet man eine hohe chirale Induktion. Folgender Ligand bildet z.B. ausschließlich einsinnige Helikate, wahrscheinlich rechtsgängige.
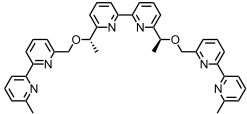
Bei oligomeren 2,2‘-Bipyridinen ist die Bildung von Tripelhelices mit oktaedrisch koordinierten Metallionen aus sterischen Gründen nicht möglich. Durch Verknüpfung der Bipyridyleinheiten in 5,5‘-Position können mit geeigneten Metallionen aber auch Tripelhelices gebildet werden.
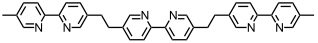
Die Selbstaggregation solcher Tripelhelices wird auch durch das Gegenion des verwendeten Metallsalzes gesteuert. Mit FeCl2 erhält man einen cyclischen pentameren Komplex, in dessen Hohlraum ein Chloridion gebunden ist. Mit Fe(BF4)2, FeSO4 oder FeSiF6 wird dagegen ein Hexamer gebildet, wobei sich auch in diesem Fall das Gegenion im Zentrum des Hohlraums befindet.
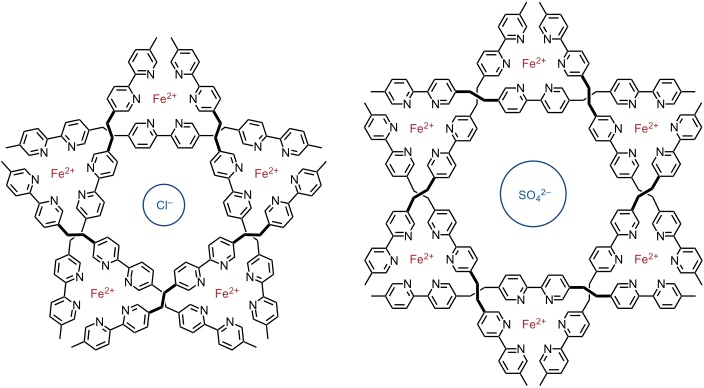
Leiter, Gitter usw.
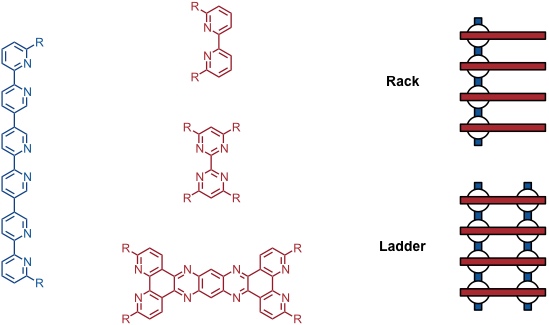
Die Komplexierung von Bipyridin mit starren, stäbchenförmigen Liganden führt zu sogenannten Regalen (racks). Bifunktionelle Liganden ergeben eine Leiter (ladder). Als Metallionen zur Koordination dienen z.B. Ag+ oder Cu+.
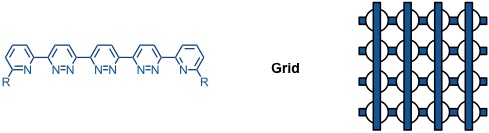
Kombiniert man mehrere stäbchenförmige Liganden, so erhält man Gitter (grids).
Durch gezielte Kombination von Liganden kann eine Vielzahl weiterer Geometrien aufgebaut werden. Als Beispiel seien zylindrische Komplexe genannt.
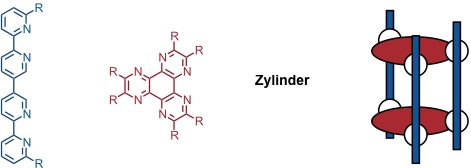
Auf analoge Weise können solche Strukturen unter Verwendung von Terpyridylliganden aufgebaut werden. In den Komplexen ist das Metallatom oktaedrisch koordiniert und es müssen dementsprechend andere Metallatome zum Aufbau verwendet werden (z.B. Fe2+, Ni2+ usw.).
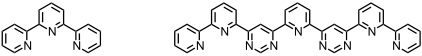
Für solche Komplexe mit einer definierten räumlichen Anordnung von mehreren Metallatomen werden interessante Eigenschaften erwartet. Fragestellungen, die mit diesen Komplexen z.B. bearbeitet werden können sind: wie wechselwirken die Metallionen miteinander? Gelingt es, nur ein Metallatom gezielt zu adressieren und z.B. zu reduzieren? Dies würde die Verwendung solcher Komplexe als Datenspeicher erlauben. In diese und andere Richtungen wird intensiv geforscht.
Ringe und Käfige
Die Synthese cyclischer oder polycyclischer Metallkomplexe basiert meist auf der Koordination von aromatischen Stickstoffbasen an geeignet substituierte Pd(II)- oder Pt(II)-Komplexe.
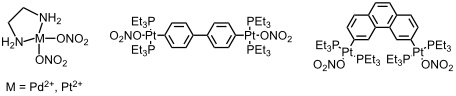
Die Nitratliganden in diesen Komplexen sind schwach gebunden und können leicht durch andere, stärker koordinierende Liganden ersetzt werden. Durch die gegebene Anordnung der Nitratliganden in den Komplexen können an den quadratisch planar koordinierten Metallatomen Geometrien von 90° oder 180° eingestellt werden.
Die Gruppe um M. Fujita zeigte, dass die Reaktion von 4,4‘-Bipyridin mit dem ersten Komplex in einem Schritt in praktisch quantitativer Ausbeute zu dem unten abgebildeten molekularen Quadrat führt.
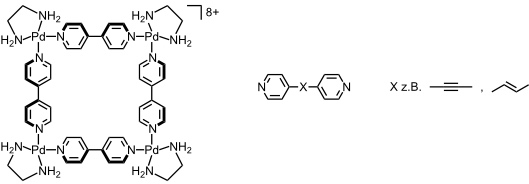
Der Bipyridinligand kann durch Einführung von Spacern zwischen die beiden Pyridyleinheiten erweitert werden. Diese Spacer führen in bestimmten Fällen dazu, dass der Ligand nicht mehr linear ist. Bei bestimmten Liganden findet man in Lösung ein Gleichgewicht zwischen einem quadratischen Komplex und einem dreieckigen, wobei der dreieckige entropisch begünstigt ist. Durch die Templateffekte geeigneter Gäste kann man das Gleichgewicht auf die Seite eines Produkts verschieben.
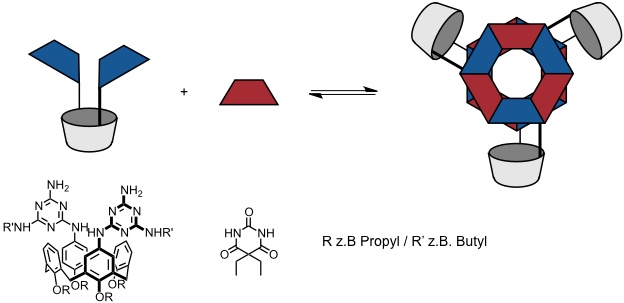
Liganden mit mehr als zwei Koordinationsstellen ergeben dreidimensionale Koordinationsverbindungen (Käfige oder Schalen). Dabei kann man durch die Struktur der Liganden bzw. die Anzahl der Koordinationsstellen die Struktur des resultierenden Komplexes kontrollieren.
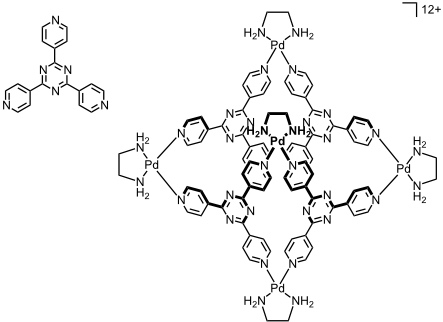
Bei Kombination des tridentaten Liganden mit [enPd(II)(NO3)2] resultiert ein oktaedrischer Koordinationskäfig der Zusammensetzung M6L4 in einer Ausbeute >90%. Durch seine hohe Ladung ist der Käfig wasserlöslich, sein Inneres ist aber hydrophob. Er kann somit unpolare Gastmoleküle einschließen, z.B. vier Adamantanmoleküle. Die Komplexierung kann NMR spektroskopisch verfolgt werden, denn die Gastprotonen werden im Inneren des Käfigs stark abgeschirmt.
Dieser Käfig kann als molekulare Reaktionskammer genutzt werden. Dabei werden bei den folgenden photochemischen [2+2]Cyclodimerisierungen hohe Stereoselektivitäten beobachtet, die auf den Raumbedarf der Olefine und des Produkts im Käfig und deren relative Anordnung zurückgeführt wurden.
![[2+2]Cyclodimerisierung](img/oc9/agg_met_14.jpg)
[Quelle: Yoshizawa, M.; Takeyama, Y.; Kusukawa, T.; Fujita, M. Angew. Chem. 2002, 114, 1403-1405: <doi>.]
Ein weiteres Beispiel für die Anwendung dieses Koordinationskäfigs ist eine sogenannte ship-in-a-bottle Synthese.
Hierbei wird PhSi(OH)3 in Gegenwart des Käfigs in siedendem Wasser polymerisiert. Bei dieser Reaktion entsteht typischerweise zunächst ein cyclisches Trimer, das außerhalb des Käfigs gleich zum thermodynamisch stabileren Tetramer und daraufhin zu weiteren oligomeren Kondensationsprodukten weiter reagiert. Ein in den Käfig eingeschlossenes Trimer kann jedoch nicht entweichen aber auch nicht weiter reagieren und ist entsprechend im Käfig über Monate stabil.
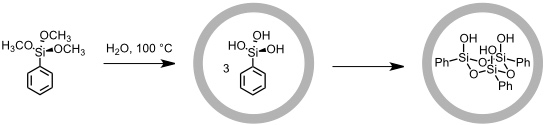
[Quelle: Yoshizawa, M.; Kusukawa, T.; Fujita, M.; Yamaguchi, K. J. Am. Chem. Soc. 2000, 122, 6311-6312: <doi>.]
Derselbe Ligand liefert mit [enPd(II)(NO3)2] und Pyrazin einen Komplex, dessen Struktur ideal für die Einlagerung elektronenreicher aromatischer Gäste ist. Für die quantitative Bildung dieses Komplexes ist die Anwesenheit eines Templats, Hexamethoxytriphenylen, essentiell. Einmal gebildet, ist der Komplex auch nach Entfernen des Templats stabil und kann zur Bindung anderer Gastmoleküle dienen. Bei Einlagerung von 1,3-Diketonen werden diese in ihrer Enolform stabilisiert.
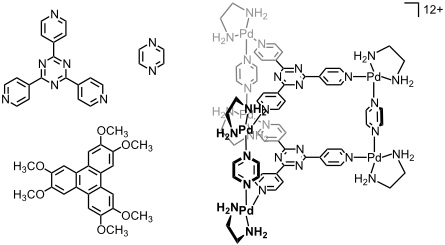
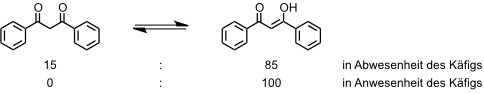
[Quelle: Kumazawa, K.; Biradha, K.; Kusukawa, T.; Okano, T.; Fujita, M. Angew. Chem. 2003, 115, 4039-4043: <doi>.]
Durch Verschieben der Ringstickstoffatome in den Pyridyleinheiten des Liganden resultiert bei Reaktion mit [enPd(II)(NO3)2] ein schalenförmiger Komplex der Zusammensetzung M6L4, der in wässriger Lösung weiter zu einer dimeren Kapsel aggregiert.
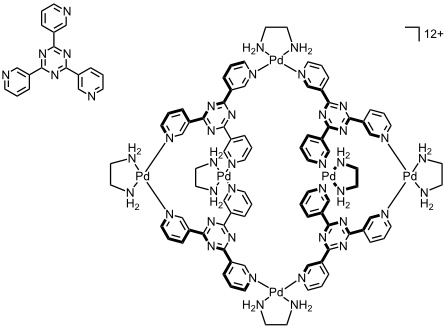
Der analoge Platin(II) Komplex bindet in wässriger Lösung das Oligopeptid Ac-Trp-Ala-Glu-Ala-Ala-Ala-Glu-Ala-Trp-NH2. Bei Komplexbildung wird eine α-helikale Struktur des Peptids stabilisiert. Der gebildete Komplex wird u.a. durch Wechselwirkungen der beiden elektronenreichen Indolringe der Tryptophaneinheiten des Peptids mit den elektronenarmen Triazinringen an der inneren Oberfläche der Koordinationsverbindung stabilisiert.
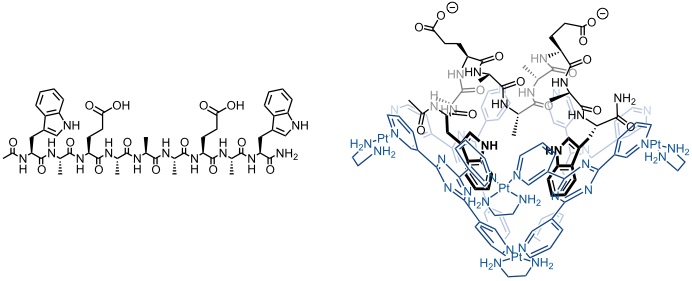
[Quelle: Tashiro, S.; Tominaga, M.; Yamaguchi, Y.; Kato, K.; Fujita, M. Angew. Chem. 2005, 118, 247-250: <doi>.]
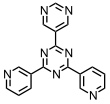
Bei Umsetzung des folgenden Liganden mit [enPd(II)(NO3)2] werden je nach anwesendem Templatmolekül unterschiedliche Koordinationskäfige gebildet. Große Templatmoleküle, z.B. Dibenzoyl PhCOCOPh, induzieren die Bildung eines Käfigs mit paralleler Anordnung der Liganden. Kleine Templatmoleküle, z.B. CBr4, induzieren die Bildung eines Käfigs mit antiparalleler Anordnung der Liganden.
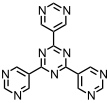
Ein Käfig der Zusammensetzung M18L6 mit einem Innenvolumen von ca 900 Å3 entsteht aus [enPd(II)(NO3)2] und einem tripodalen Liganden mit sechs Donoratomen. Aufgrund der geschlossenen Oberfläche dieses Käfigs ist ein Gastaustausch nicht möglich.
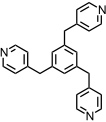
Bei Verwendung des folgenden flexiblen Liganden beobachtet man in Anwesenheit von [enPd(II)(NO3)2] zunächst eine komplexe Mischung verschiedener Produkte. Erst in Anwesenheit eines Gastmoleküls, z.B. 4-Methoxyphenylacetat, wird ein definierter Käfig gebildet, der genau ein Gastmolekül enthält. Die geordnete (poly)cyclische Struktur solcher Komplexe ist also nicht immer die thermodynamisch stabilste, sie kann es aber durch zusätzliche Wechselwirkungen mit einem eingelagerten Gastmolekül werden.
Große Käfige
Palladium(II)- oder Platin(II)-Ionen bilden mit stickstoffhaltigen Liganden quadratisch planare Komplexe. Verwendet man geeignet gewinkelte ditope Liganden, kann man gezielt Koordinationskäfige aufbauen. Dabei kann man die Größe bzw. Zusammensetzung der Komplexe durch den Bisswinkel der Liganden steuern.
Ein Kuboktaeder der Zusammensetzung M12L24 erhält man durch Umsetzung von Pd2+ mit Liganden, deren Donoratome einen Winkel von ca. 120° einschließen.
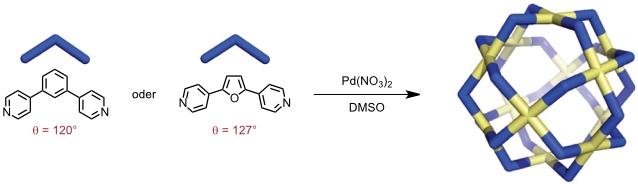
Entsprechende Komplexe mit Pt2+ bilden sich langsamer, sind aber kinetisch inert.
Mit einem Liganden, dessen Donorstellen in einem Winkel von 90° stehen, enthält man einen Koordinationskäfig der Zusammensetzung M6L12 mit der Struktur eines Würfels (Palladiumzentren auf den Würfelflächen).
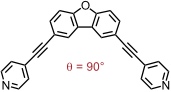
Bei Vergrößerung des Bisswinkels der Liganden wird die Bildung des Kuboktaeders benachteiligt. Ab einem Grenzwinkel zwischen 131-134° wird ein (kleines) Rhombenkuboktaeder der Zusammensetzung M24L48 favorisiert.
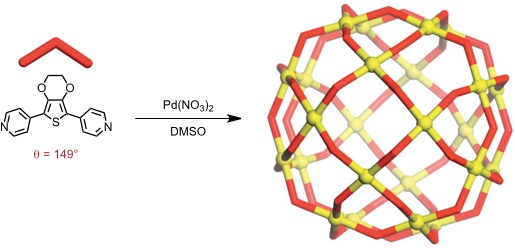
Die Bestimmung des Grenzwinkels, der den Übergang vom Kuboktaeder zum Rhombenkuboktaeder definiert, gelang durch Verwendung von Gemischen zweier Liganden.
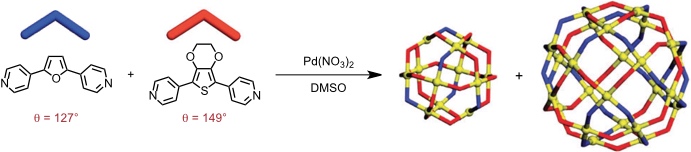
| Verhältnis Furan/Thiophen | Durchschnittwinkel | Produkt |
| 8:2 | 131,4 | nur M12L24 |
| 7:3 | 133,6 | nur M24L48 |
Dieser Befund gestattet es vorherzusagen, welcher Koordinationskäfig aus folgenden Liganden gebildet wird.
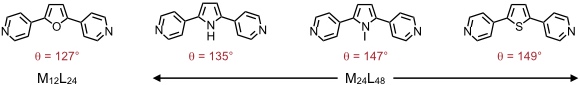
Ein weiterer Vorteil der "gekrümmten" Liganden ist, dass man an definierten Positionen Substituenten einführen kann, welche somit entweder im Inneren oder entlang der äußeren Oberfläche der Käfige angeordnet werden.
Da die Koordinationskäfige außerdem ein großes inneres Volumen haben, ist es sogar gelungen, mit dieser Strategie Ubiquitin (8,6 kDa, ca. 3-4 nm Durchmesser) im Inneren eines M12L24 Koordinationskäfigs zu verkapseln.
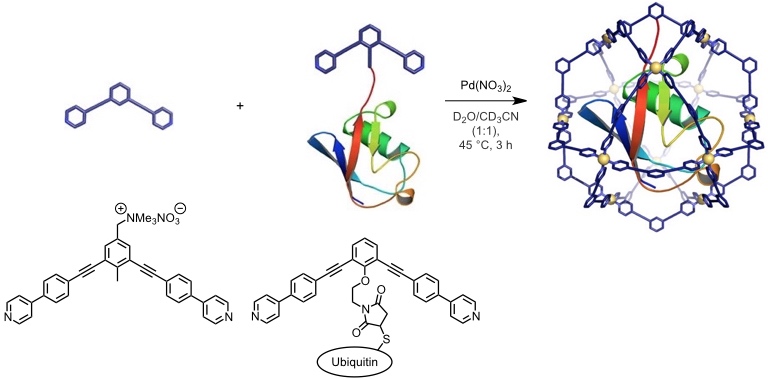
[Quelle: Fujita, D.; Suzuki, K.; Sato, S.; Yagi-Utsumi, M.; Yamaguchi, Y.; Mizuno, N.; Kumasaka, T.; Takata, M.; Noda, M.; Uchiyama, S.; Kato, K.; Fujita, M. Nat. Commun. 2012, 3, 1093: <doi>.]
Subcomponent Self-Assembly
Das von J. R. Nitschke zum Aufbau supramolekularer Koordinationskomplexe verwendete Konzept, der sogenannte "Subcomponent Self-Assembly" beruht auf der Bildung metallstabilisierter Iminkomplexe aus geeigneten molekularen Untereinheiten, von denen eine eine Aldehydgruppe und die andere eine Aminogruppe enthält.
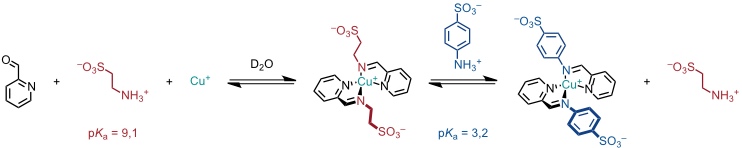
Jede einzelne der Komplexkomponenten, das Metall und die Liganden, sind in wässriger Lösung nicht stabil: Imine sind sehr hydrolyseempfindlich und Kupfer(I) disproportioniert leicht in elementares Kupfer und Kupfer(II). Die gebildeten Komplexe sind aber thermodynamisch stabil, wenn auch häufig kinetisch labil.
Die kinetische Labilität bewirkt, dass die Komplexe sich strukturell an externe Stimuli anpassen können, wenn z.B. die Zusammensetzung der Lösung verändert wird. Im obigen Beispiel beobachtet man beispielsweise den vollständigen Austausch des aliphatischen gegen das aromatische Amin. Dies erklärt man durch die geringere Basizität des aromatischen Amins (höhere Acidität der konjugierten Säure). Bei Verwendung von Eisen(II) anstelle von Kupfer(I) bilden sich oktaedrische Komplexe mit drei Liganden. Dieses Konzept wurde zur Darstellung zahlreicher Helikate verwendet. Im Rahmen der Vorlesung wird auf diese Arbeiten aber nicht eingegangen, sondern nur die in der Nitschke Gruppe entwickelten Koordinationskäfige vorgestellt.
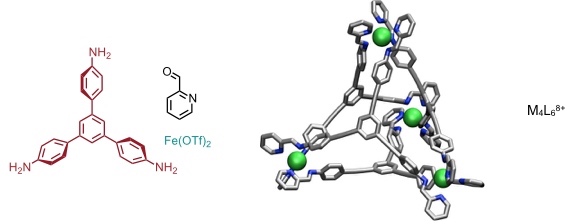
Komplexbildung des von einem 4,4’-Diaminobiphenyl abgeleiteten Disulfonats mit 2-Formylpyridin und Eisen(II) führt zu einem tetraedrischen Koordinationskäfig der Zusammensetzung M4L6. Dieser Käfig bindet Cyclohexan. Bei Veränderung des pH Werts der Lösung kann der Käfig gezielt assembliert und disassembliert werden, wobei das eingeschlossene Cyclohexan gebunden bzw. freigesetzt wird.
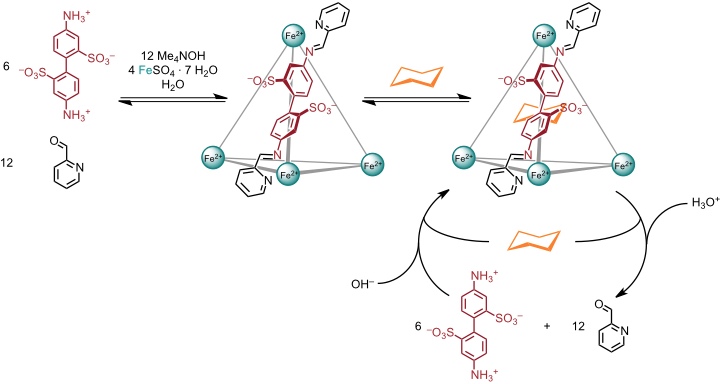
Ein alternativer Stimulus ist die Zugabe von Tris-2-aminoethylamin. Dieses Triamin bildet nach Iminbildung mit 2-Formylpyridin einen stabilen Komplex mit Eisen(II). Die Bildung vier dieser Komplexe aus dem Tetraeder ist entropisch bevorzugt. Entsprechend liegt das Gleichgewicht auf der Seite der einkernigen Komplexe und es kommt auch unter diesen Bedingungen zu einer Freisetzung des Cyclohexans.
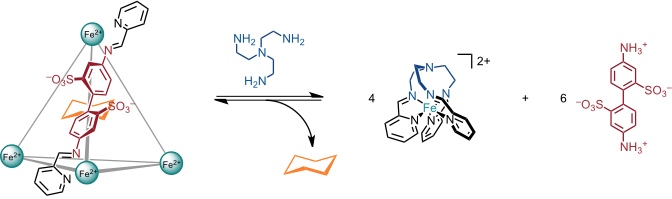
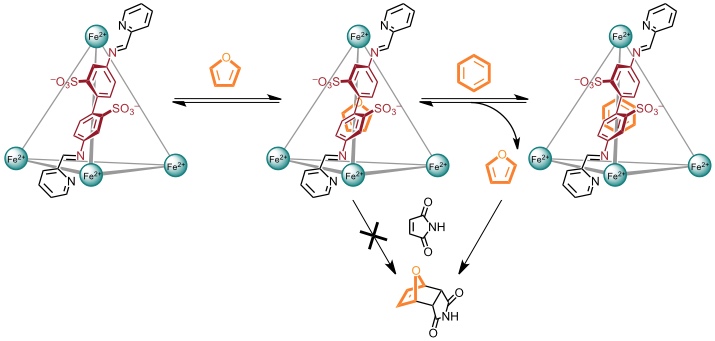
Dieser Koordinationskäfig bindet außerdem weißen Phosphor und stabilisiert diesen in wässriger Lösung. Die Zugabe von Benzol führt dazu, dass P4 freigesetzt wird, weil Benzol einen stabileren Komplex mit dem Käfig bildet. Der freigesetzte weiße Phosphor zeigt dann seine übliche Reaktivität, er wird in Gegenwart von Luft beispielsweise leicht zu Phosphorsäure oxidiert.
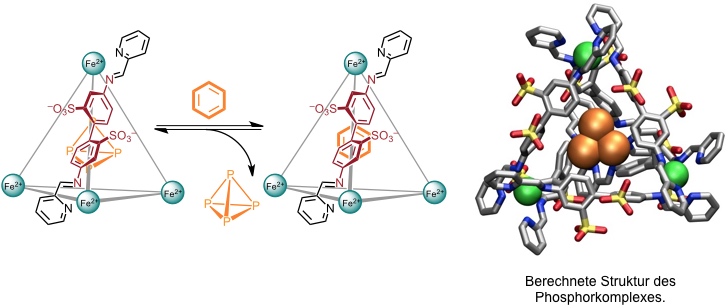
[Für eine interaktive Version der Kristallstruktur hier klicken]
Enthält der Käfig Furan, wird das eingeschlossene Gastmolekül durch die Komplexierung geschützt und kann dadurch nicht mit Maleimid reagieren. Bei Zugabe von Benzol zu der Lösung kommt es zur Freisetzung des Furans, welches nun von Maleimid zum Diels-Alder-Addukt abgefangen wird.
Mit komplementären Bausteinen, nämlich einem [3,3’-Bipyridin]-6,6'-dicarbaldehyd und Anilin erhält man ebenfalls einen tetraedrischen Koordinationskäfig. Bei Verwendung substituierter Anilinderivate kann man den Käfig auf der Oberfläche mit entsprechenden Gruppen dekorieren.
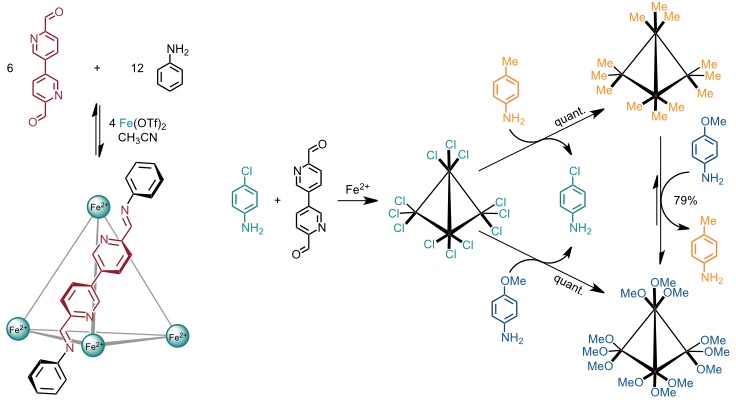
Mit tripodalen Triaminen, 2-Formylpyridin und Eisen(II) im Verhältnis 4 : 12 : 4 erhält man ebenfalls einen tetraedrischen Käfig, wobei allerdings die Liganden auf dessen Flächen angeordnet sind. Bei einem Verhältnis von Triamin : Aldehyd : Eisen(II) = 3 : 6 : 2 erhält man aus denselben Bausteinen ein Helikat der Zusammensetzung M2L3.
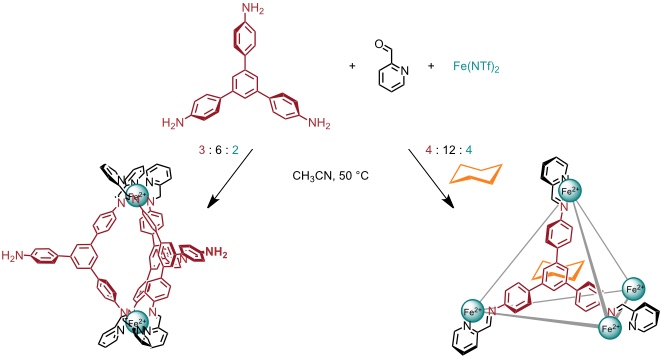
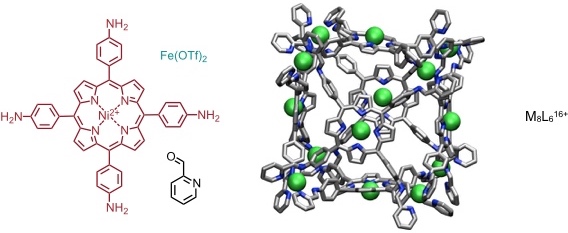
Die Abbildungen zeigen die berechneten Strukturen der tetraedrischen Kapsel mit dem Triamin und der eines Würfels mit einem auf einem Porphinring basierenden Tetraamin.
[Für eine interaktive Version der Kristallstruktur hier klicken]
[Für eine interaktive Version der Kristallstruktur hier klicken]
Anionischer Koordinationskäfig
In der Gruppe von Raymond wurde folgender Tetragalliumkomplex entwickelt, der aufgrund der Catecholatliganden insgesamt zwölffach negativ geladen ist. Der Komplex ist chiral, bei der Bildung wird allerdings das Racemat der beiden ΔΔΔΔ und ΛΛΛΛ Enantiomere gebildet. Das Innenvolumen der hydrophoben Kavität beträgt ca. 450 Å3.
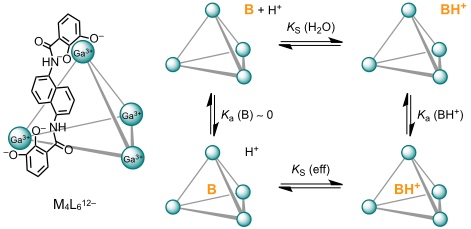
Dieser Käfig bindet aufgrund der Kombination von Coulomb- und Kation-π Wechselwirkungen in wässriger Lösung effizient an Kationen. Dabei ist die Komplexbildung wegen der Freisetzung von Lösungsmittelmolekülen aus der Komplexkavität entropisch bevorzugt. Die Affinität des Komplexes für Kationen führt dazu, dass Amine in ihrer protonierten Form auch bei einem pH-Wert stabilisiert werden, bei dem sie als Ammoniumionen normalerweise nicht vorliegen.
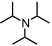
| pKS | 10,7 |
| log Ka (BH+) | 2,7 |
| pKS (eff) | 13,4 |
Die Stabilisierung kationischer Spezies erklärt die katalytische Aktivität dieses Koordinationskäfigs bei Reaktionen mit kationischen Zwischenstufen. Wir werden hierauf im Kapitel Supramolekulare Katalyse zurück kommen.
Sulfat-bindender Koordinationskäfig
Aufgrund der nach Innen weisenden Harnstoffgruppen bindet ein von Custelcean et al. entwickelter Tetranickelkomplex mit hoher Affinität (log Ka ca. 6 in Wasser) Sulfatanionen in seinem Inneren. Dieser Komplex stellt eines der wenigen Beispiele für käfigartige Rezeptoren dar, die nach innen weisende Wasserstoffbrückendonatoren besitzen. Die innere Oberfläche der meisten anderen strukturverwandten Rezeptoren ist unpolar, sodass Gäste beispielsweise durch dispersive Wechselwirkungen, Kation-π Wechselwirkungen und hydrophobe Effekte gebunden werden.
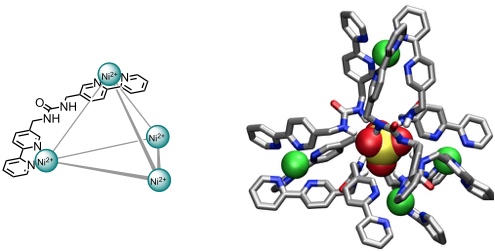
[Für eine interaktive Version der Kristallstruktur hier klicken]
[Quelle: Custelcean, R.; Bosano, J.; Bonnesen, P. V.; Kertesz, V.; Hay, B. P. Angew. Chem. 2009, 121, 4085-4089: <doi>.]
Literatur
- Fujita, M. "Metal-Directed Self-Assembly of Two- and Three-Dimensional Synthetic Receptors" Chem. Soc. Rev. 1998, 27, 417-425: <doi>.
- Leininger, S.; Olenyuk, B.; Stang, P. J. "Self-Assembly of Discrete Cyclic Nanostructures Mediated by Transition Metals" Chem. Rev. 2000, 100, 853-908: <doi>.
- Fujita, M.; Tominaga, M.; Hori, A.; Therrien, B. "Coordination Assemblies from a Pd(II)-Cornered Square Complex" Acc. Chem. Res. 2005, 38, 371-380: <doi>.
- Albrecht, M. "Let's Twist Again - Double Stranded, Triple-Stranded, and Circular Helicates" Chem. Rev. 2001, 101, 3457-3498: <doi>.
- Nitschke, J. R. "Construction, Substitution, and Sorting of Metallo-organic Structures via Subcomponent Self-Assembly" Acc. Chem. Res. 2007, 40, 103-112: <doi>.
- Chakrabarty, R.; Mukherjee, P. S.; Stang, P. J. "Supramolecular Coordination: Self-Assembly of Finite Two- and Three-Dimensional Ensembles" Chem. Rev. 2011, 111, 6810-6918: <doi>.
- Harris, K.; Fujita, D.; Fujita, M. "Giant Hollow MnL2n Spherical Complexes: Structure, Functionalisation and Applications" Chem. Commun. 2013, 49, 6703-6712: <doi>.
- Ronson, T. K.; Zarra, S.; Black, S. P.; Nitschke, J. R. "Metal-organic Container Molecules Through Subcomponent Self-Assembly" Chem. Commun. 2013, 49, 2476-2490: <doi>.
Letzte Änderung: 23-03-30. Email

