Lehre - Supramolekulare Chemie - Molekulare Maschinen
Einleitung
Eine (makroskopische) Maschine ist ein Gerät, das aus mehreren miteinander wechselwirkenden Bauelementen besteht, die in ihrer Gesamtheit eine Funktion ergeben, welche jedes Element für sich nicht besitzt. Diese Definition einer Maschine ist zwanglos in den molekularen Bereich übertragbar. Vor allem durch die Entwicklung der supramolekularen Chemie und durch das dadurch gewachsene Verständnis, intermolekulare Wechselwirkungen zu kontrollieren, ist es möglich geworden, molekulare Systeme zu entwickeln, die eine vorhersagbare Funktion besitzen.
Künstliche molekulare Maschinen sind allerdings selten rein supramolekular aufgebaut, d.h. durch nicht-kovalente Wechselwirkungen. Meist handelt es sich um kovalent verknüpfte Moleküle oder solche mit mechanischen Bindungen (Rotaxane, Catenane) und supramolekulare Prinzipien werden nur für deren Synthese ausgenutzt.
Das Vorbild für viele molekulare Maschinen ist wie so oft die Natur. So existieren in biologischen Systemen eine Reihe von Molekülaggregaten, sie man als Maschinen bezeichnen kann.
- In der ATP-Synthase ist die protonengetriebene Synthese von ATP mit einer gerichteten Rotation miteinander wechselwirkender Proteine verbunden. Diese Bewegung wird von einigen Bakterien zur Fortbewegung ausgenutzt.
- Muskelbewegungen werden durch das aneinander vorbei Gleiten von Proteinfilamenten (Aktin, Myosin) bewirkt. Dieser Prozess wird durch die Hydrolyse von ATP getrieben.
- Kinesin und Dynein sind ATP getriebene Motoren, die Vesikel und Organellen auf Mikrotubulibahnen bewegen.
Ausschnitt aus The Inner Life of a Cell by Cellular Visions and Harvard.
Inzwischen existieren eine Reihe von synthetischen Systemen, mit denen ebenfalls eine gerichtete molekulare Bewegung erzielt werden kann. Einige ausgewählte Beispiele werden im Folgenden vorgestellt.
Molekulare Shuttle und Schalter
Als Shuttle kann man Ringe bezeichnen, die sich auf der Achse eines Rotaxans zwischen Stationen bewegen.
Sind die Stationen identisch, ist die Bewegung mehr der weniger schnell aber nicht kontrollierbar. Ein Beispiel für ein Rotaxan dieser Art ist das in der Gruppe von J. F. Stoddart entwickelte Shuttle, in dem der Ring 1800 mal pro Sekunde bei Raumtemperatur den Platz wechselt.
Ein Shuttle, in dem die Bewegung des Rings kontrolliert werden kann, muss strukturell unterschiedliche Positionen in der Achse enthalten. So kommt man durch Einbau einer Benzidin- und einer Bisphenoleinheit in die Achse des obigen Rotaxans zu einem elektrochemisch schaltbaren Shuttle.
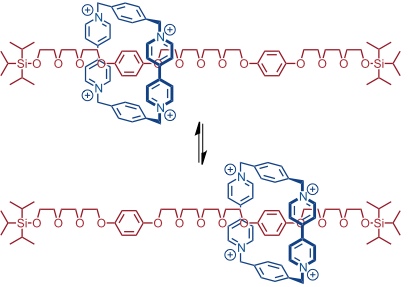
Im reduzierten Zustand befindet sich der Ring aufgrund der elektronenarmen Paraquatsysteme bevorzugt am elektronenreichen Benzidin. Wird dieses allerdings elektrochemisch oxidiert, kommt es zu einer elektrostatischen Abstoßung, sodass der Ring auf die Seite der Bisphenolstation wechselt. Der Platzwechsel ist völlig reversibel und das System kann durch Reduktion des Benzidins wieder in den Ausgangszustand überführt werden.
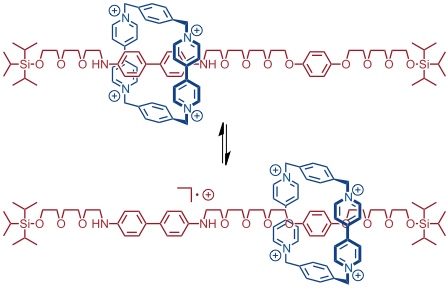
Dieses Rotaxan ist nicht nur elektrochemisch, sondern auch durch Protonierung/Deprotonierung schaltbar. So kann man das Benzidin durch Zugabe von Trifluoressigsäure protonieren, wodurch der Ring seine bevorzugte Position verlässt. Deprotonierung führt dann wieder zum Ausgangspunkt zurück.
Analoge Strategien sind von der Gruppe um J.-P. Sauvage verwendet worden, um schaltbare Rotaxane und Catenane zu generieren, wobei aber Metallkomplexe als Bauelemente verwendet wurden und Redoxprozesse an den Metallzentren, um den Schaltvorgang auszulösen.
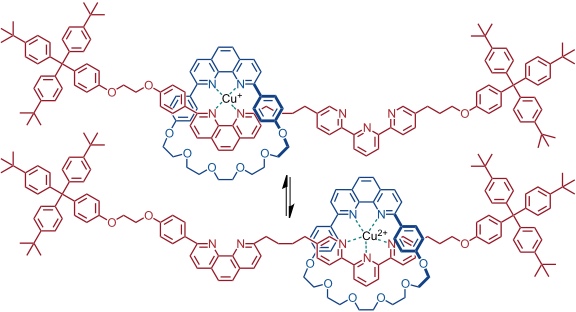
Zwischen den Zuständen kann durch Cyclovoltammetrie geschaltet werden.
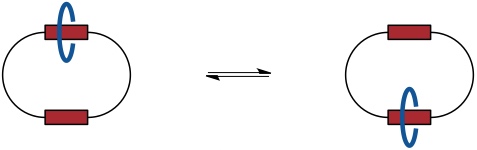
Auch ein Catenan, in dem sich der kleinere Ring entlang des großen zwischen zwei Stationen bewegt, kann als molekulares Shuttle aufgefasst werden.
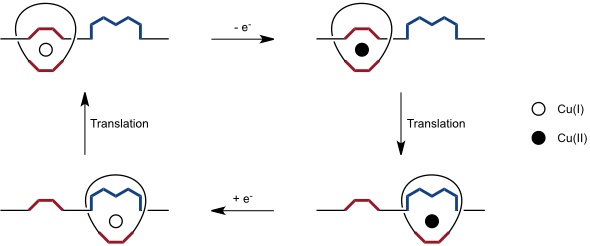
Solche Shuttles wurden ebenfalls auf Basis der von J.-P. Sauvage entwickelten Strategie unter Ausnutzung bevorzugter Koordinationsgeometrien von Metallionen in verschiedenen Oxidationszuständen entwickelt.
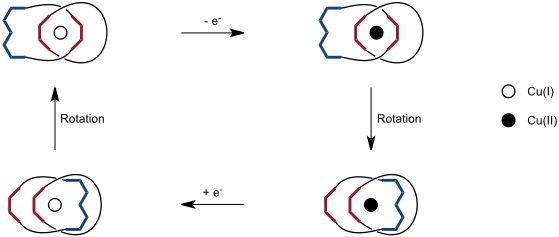
Alternativ kann man ein schaltbares Catenan aus zwei identischen Ringen mit jeweils einer Phenanthrolin- und einer Terpyridineinheit aufbauen. In diesem Fall wechselt die Koordination zwischen der tetraedrischen bei Cu(I) und der oktaedrischen bei Cu(II).
Schaltbare Catenane können als molekulare Rotoren bezeichnet werden. Allerdings kann in einfachen Systemen nicht kontrolliert werden, ob die Umlagerung immer in dieselbe Richtung erfolgt und dadurch eine echte, gerichtete Drehung zustande kommt oder ob es nur eine Schaukelbewegung gibt.
Ein Catenan, in dem eine gewisse gerichtete Bewegung möglich ist wurde von D. A. Leigh entwickelt. Station A kann selektiv durch Bestrahlung mit Licht der Wellenlänge 350 nm in das entsprechende Z konfigurierte Derivat überführt werden (die Benzophenoneinheit dient als Sensibilisator). Durch die Isomerisierung sinkt die Affinität des kleineren Ringes zu dieser Station und er wechselt zu B. Wenn auch B durch Bestrahlung mit Licht der Wellenlänge 254 nm in die Z Form überführt wird, wechselt der kleine Ring zu Station C. Die thermische Rückisomerisierung der Z Formen von A und B führt dazu, dass der kleinere Ring wieder zur Station A wechselt. Die Bewegung des kleinen Rings erfolgt zwar insgesamt mit der Sequenz A → B → C → A, sie ist aber nicht wirklich unidirektional, da im letzten Schritt der kleinere Ring in beide Richtungen, also direkt oder indirekt über B nach A wandern kann.
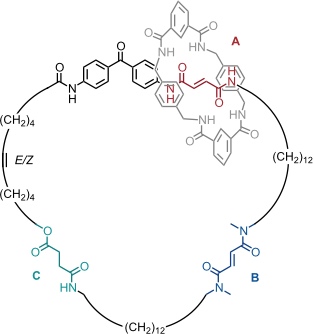
Wirkliche Unidirektionalität kann man in einem entsprechenden [3]Catenan realisieren, in dem zwei kleine Ringe auf den größeren aufgefädelt sind. Zunächst befinden sich die beiden Ringe 1 und 2 an den Bindungsstellen A und B. Durch Bestrahlung mit langwelligem UV-Licht wird A selektiv in die Z Form umgewandelt. Im Anschluss wandert Ring 1 zur Bindungsstelle C. Diese Bewegung muss gegen den Uhrzeigersinn erfolgen, da Station B durch Ring 2 besetzt ist. Nun wird mit kurzwelligem UV Licht bestrahlt und auch B in die Z Form isomerisiert. Ring 2 verlässt nun B, kann aber nur gegen den Uhrzeigersinn wandern. Er bindet im Endzustand an die Amidgruppe im Benzophenon, die als vierte Station fungiert. Die thermische Rückisomerisierung der beiden Z Formen von A und B in die E Formen führt dazu, dass Ring 2 zur Bindungsstelle A wandert und Ring 1 zur Bindungsstelle B. Dafür gibt es nur einen möglichen Weg.
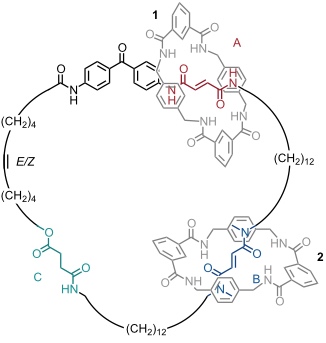
Durch diese Sequenz haben die Ringe 1 und 2 ihre Plätze getauscht. Um eine vollständige Rotation zum Ausgangszustand durchzuführen, müssen die drei Schritte wiederholt werden. Die beiden kleinen Ringe haben dann je drei Bewegungen gegen den Uhrzeigersinn und eine im Uhrzeigersinn vollzogen. Über den Gesamtprozess gesehen, entspricht dies einer gerichteten relativen Bewegung gegen den Uhrzeigersinn.
Molekulare Muskeln
In der Gruppe von J.-P. Sauvage wurde ein Rotaxandimer entwickelt, das eine ausgedehnte und eine kontrahierte Struktur annehmen kann. Beide Strukturen kann man gezielt ineinander umwandeln, wodurch eine gewisse Ähnlichkeit mit der Funktionsweise eines Muskels gegeben ist.
Dieses Rotaxandimer besteht aus zwei identischen Komponenten, welche jeweils einen Kronenether mit einer 1,10-Phenanthrolineinheit enthalten und eine an diesen Ring gebundene Achse mit einer 1,10-Phenanthrolin- und einer Terpyridineinheit.
Der schematische Aufbau des Dimers als Dikupfer(I) Komplex, welcher der ausgedehnten Form des molekularen Muskels entspricht, kann folgendermaßen dargestellt werden.
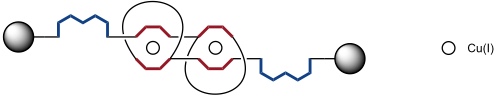
Wie in den molekularen Shuttles von Sauvage war zunächst geplant, den Muskel durch Redoxprozesse zu schalten. Diese Strategie konnte aber nicht realisiert werden, da sich der aus dem Cu(I) Komplex elektrochemisch hergestellte Cu(II) Komplex mit zwei tetraedrisch koordinierten Kupferatomen als kinetisch zu stabil erwies und nicht in die thermodynamisch stabilere Form mit zwei fünffach koordinierten Cu(II) Zentren überging.
Darum wurde zum Schalten ein Zweistufenprozess realisiert. Zunächst wurde das System durch Zugabe von KCN in eine metallfreie Form überführt. Anschließend wurde der Dizink(II) Komplex hergestellt, in dem die beiden Metallatome fünffach koordiniert sind. In dieser Form besitzt das Rotaxandimer eine kontrahierte Form wie die folgende Darstellung verdeutlicht.
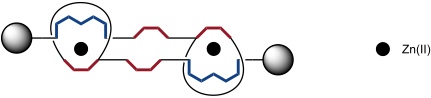
[Quelle: Jiménez, M. C.; Dietrich-Buchecker, C.; Sauvage, J.-P. Angew. Chem. 2000, 112, 3422-3425: <doi>.]
Ausgehend von diesen Arbeiten haben sich auch andere Gruppen mit der Entwicklung molekularer Muskel beschäftigt, die elektrochemisch oder photochemisch schaltbar sind.
[Quelle: Liu, Y.; Flood, A. H.; Bonvallet, P. A.; Vignon, S. A.; Northrop, B. H.; Tseng, H.-R.; Jeppesen, J. O.; Huang, T. J.; Brough, B.; Baller, M.; Magonov, S.; Solares, S. D.; Goddard, W. A.; Ho, C.-M.; Stoddart, J. F. J. Am. Chem. Soc. 2005, 127, 9745-9759: <doi>.]
Synthetisches Ribosom
Das Ribosom in Zellen dient zur Proteinsynthese. In der Gruppe von Leigh wurde ein Rotaxan entwickelt, das die sequentielle Synthese eines kurzen Peptids gestattet, wodurch seine Funktion eine gewisse Ähnlichkeit mit der des Ribosoms besitzt. Das Rotaxan wurde mithilfe der active metal template Strategie dargestellt.
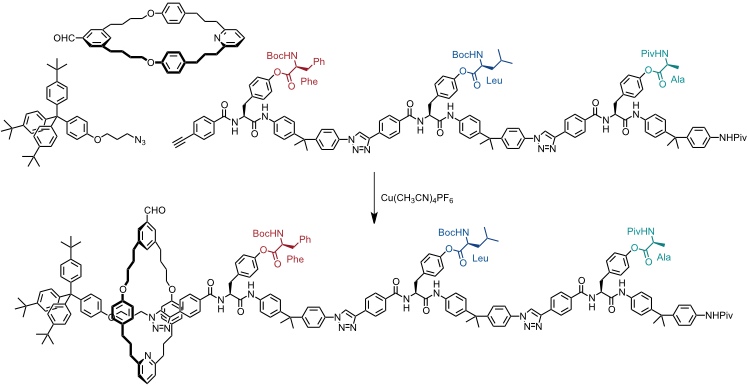
Die Aminosäuren an den einzelnen Untereinheiten des Rotaxans verhindern das Abgleiten des Ringes. Nach Entschützen der Thiolgruppe und der Aminogruppen kommt es zu einer Sequenz aus Bildung eines Thioesters durch nucleophilen Angriff der Thiolgruppe in der Seitenkette des Cysteinrests gefolgt von intramolekularer Amidierung unter Freisetzung der Thiolgruppe und Kettenverlängerung der an den Ring gebundenen Peptidsequenz.
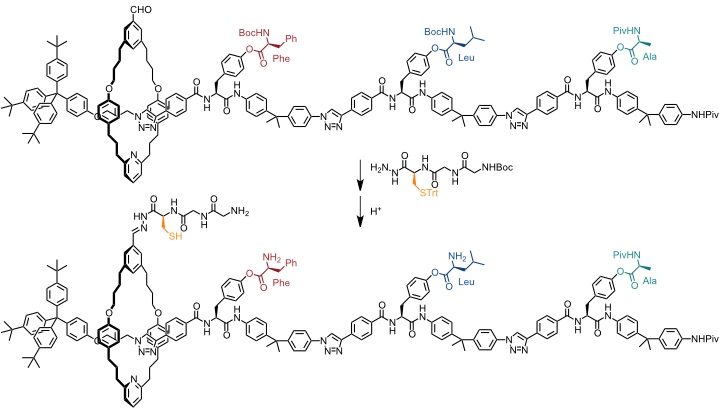
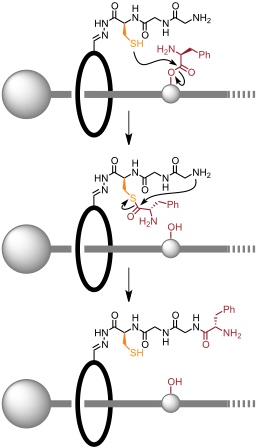
Bei dieser Reaktionssequenz erfolgt zunächst Übertragung des Phenylalaninrests und dann des Leucin- und schließlich des Alaninrests.
Diese Sequenz ist genau kontrolliert, denn bevor nicht die eine Aminosäure an den Ring gebunden ist kann er die nächste nicht erreichen. Erst wenn die letzte Aminosäure reagiert hat, kann der Ring von der Achse abgleiten. Er enthält in diesem Moment alle drei Aminosäuren, die ursprünglich an der Achse gebunden waren, in definierter Sequenz.
[Quelle: Lewandowski, B.; De Bo, G.; Ward, J. W.; Papmeyer, M.; Kuschel, S.; Aldegunde, M. J.; Gramlich, P. M. E.; Heckmann, D.; Goldup, S. M.; D’Souza, D. M.; Fernandes, A. E. Leigh, D. A. Science 2013, 339, 189-193: <doi>.]
Molekulare Ventile
Unter molekularen Ventilen versteht man Rotaxane oder Pseudorotaxane, die auf der Oberfläche eines porösen Kieselgels immobilisiert sind. In die Poren des Kieselgels kann ein Gastmolekül, z.B. ein Farbstoff, eingelagert werden, der - wenn sich der Ring des Rotaxans in der Nähe der Kieselgeloberfläche befindet - nicht entweichen kann. Durch einen äußeren Einfluss (Redoxprozess, pH-Wert Änderung) wechselt der Ring des Rotaxans die Position auf der Achse oder wird von der Achse abgefädelt. Dadurch öffnen sich die Poren und Gastmoleküle können aus den Poren des Kieselgels heraus diffundieren.
In einem molekularen Ventil, das durch Redoxchemie reversibel geöffnet und geschlossen werden kann, enthält die Achse ein Dihydroxynaphthalin und ein Tetrathiafulvalen als Stationen für einen Bis(paraquat)ring.
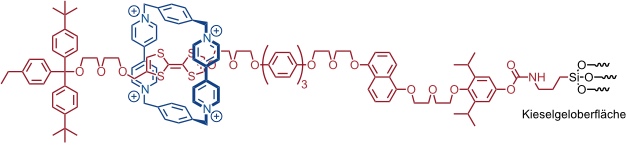
Der kleine Ring befindet sich bevorzugt auf der Tetrathiafulvalenstation. In diesem Zustand können Gastmoleküle, z.B. der Farbstoff Rhodamin B, in die Poren des Kieselgels eingelagert werden. Durch Zugabe von Fe(ClO4)3 wird das Tetrathiafulvalen zum Dikation oxidiert. Dadurch wechselt der Bis(paraquat)ring seinen Platz auf der Achse und befindet sich im Anschluss über der Naphthalineinheit, wodurch das Ventil geschlossen wird. Man erkennt dies eindeutig daran, dass die eingelagerten Gastmoleküle nicht aus den Poren des Kieselgels diffundieren.
Die Reduktion des Tetrathiafulvalendiakations durch Zugabe von Ascorbinsäure und der damit verbundene Platzwechsel des Bis(paraquat)rings auf der Achse des Rotaxans führt zu einer Freisetzung der Farbstoffmoleküle. Dieser Prozess ist vollkommen reversibel und kann durch erneutes Füllen der Kieselgelporen und Oxidation des Tetrathiafulvalens rückgängig gemacht werden.
[Quelle: Nguyen, T. D.; Tseng, H.-R.; Celestre, P. C.; Flood, A. H.; Liu, Y.; Stoddart, J. F.; Zink, J. I. Proc. Natl. Acad. Sci. USA, 2005, 102, 10029-10034: <doi>.]
Auf analoge Weise funktioniert ein Ventil, das durch Veränderung des pH-Wert geöffnet werden kann. In diesem Fall ist auf dem Kieselgel ein Pseudorotaxan gebunden, dessen Ring im protonierten Zustand der Achse die Kieselgelporen verschließt. Die Deprotonierung der Achse und anschließende Dekomplexierung des Kronenethers führt zur Öffnung der Poren und zur Freisetzung der eingelagerten Farbstoffmoleküle (in diesem Fall Coumarin 460).
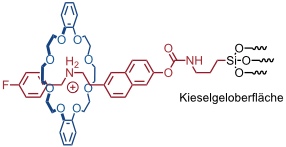
[Quelle: Nguyen, T. D.; Leung, K. C.-F.; Liong, M.; Pentecost, C. D.; Stoddart, J. F.; Zink, J. I. Org. Lett. 2006, 8, 3363-3366: <doi>.]
Molekulare Motoren
In diesem Abschnitt sollen zwei Moleküle vorgestellt werden, mit denen eine unidirektionale Rotation realisiert wurde, die aber im Gegensatz zu dem Catenan von Leigh rein kovalent aufgebaut sind.
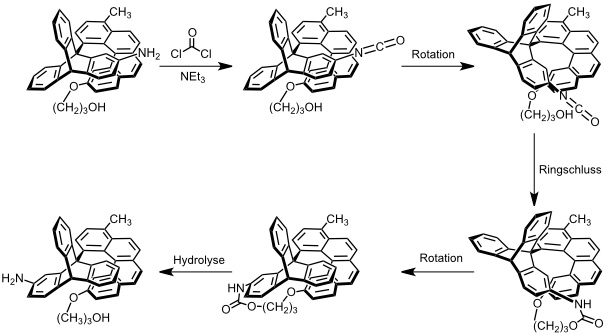
So wurde durch gezieltes Design in der Gruppe um T. R. Kelly ein Trypticen-Helicen-Konjugat entwickelt, in dem die Rotation um die zentrale Einfachbindung chemisch durch Reaktion mit Phosgen angetrieben wird. Für eine Drittel Umdrehung sind zwei Reaktions- und ein Hydrolyseschritt notwendig. Die Drehrichtung wird durch die Konfiguration des Moleküls bestimmt. Eine Drehung um 360° konnte aber noch nicht realisiert werden.
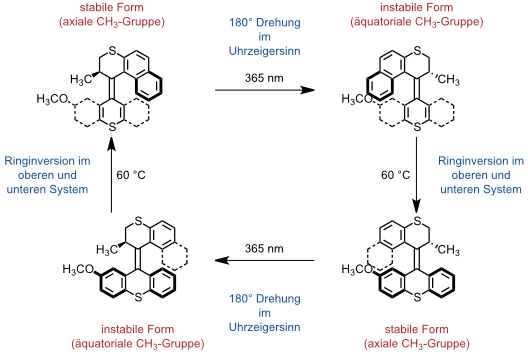
Die Gruppe um B. L. Feringa beschrieb einen Motor, der photochemisch angetrieben wird. Diese Verbindung basiert auf einem chiralen, helikalen Alken, das um die zentrale Doppelbindung eine gerichtete Drehbewegung ausführt. Die Rotationsrichtung wird durch die Konfiguration an dem einen Stereozentrum bestimmt.
Diese Moleküle wurden an Trägern immobilisiert und die Rotation in mechanische Arbeit übersetzt.
Nanocars
Mit der Entwicklung von molekularen Fahrzeugen beschäftigt sich die Gruppe von J. M. Tour. Die Moleküle enthalten kugelförmige Untereinheiten als Räder, beispielsweise C60 Einheiten, die mit dem Chassis über rotierbare Bindungen verknüpft sind. Nach Adsorption diese Moleküle auf Oberflächen (Au(111)) konnte deren thermisch oder mittels der STM Spitze induzierte Bewegung Raster-Tunnel-mikroskopisch nachgewiesen werden. Diese Aufnahmen sprechen für eine Rotation der Räder und nicht für ein einfaches Gleiten der Moleküle auf der Oberfläche.
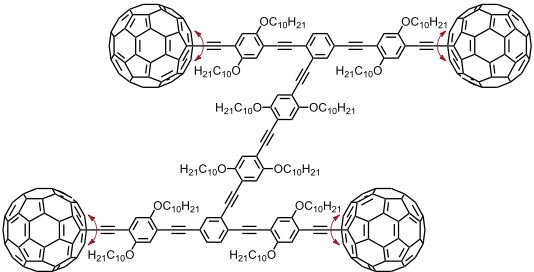
[Quelle: Shirai, Y.; Osgood, A. J.; Zhao, Y.; Kelly, K. F.; Tour, J. M. Nano Lett. 2005, 5, 2330-2334: <doi>.]
Die nächste Generation diese Nanocars enthielt den von Feringa entwickelten molekularen Motor, um ein lichtinduziertes und thermisch induziertes, gerichtetes Fahren zu ermöglichen. Die Fullereneinheiten wurden gegen Carborane ausgetauscht, da die Fullerene aufgrund ihrer Absorptionseigenschaften das Schalten des Motors störten.
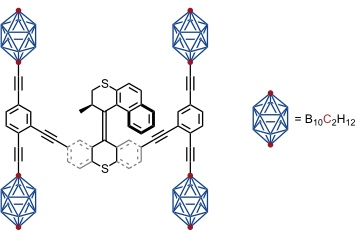
Bei diesem Nanocar erwies sich die Frequenz der Drehbewegung des Motors als zu gering, um ein lichtinduziertes Fahren zu ermöglichen.
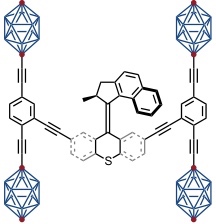
Der in diesem Nanocar verbaute molekulare Motor rotiert nach Ergebnissen von Feringa mit deutlich höherer Frequenz aber auch für dieses Molekül konnte bisher keine lichtinduzierte Bewegung auf einer Oberfläche nachgewiesen werden. Bei anderen Verbindungen konnte diese Bewegung aber inzwischen realisiert werden.
[Quelle: Chiang, P.-T.; Mielke, J.; Godoy, J.; Guerrero, J. M.; Alemany, L. B.; Villagómez, C. J.; Saywell, A.; Grill, L.; Tour, J. M. ACS Nano 2012, 6, 592-597: <doi>.]
Literatur
- Balzani, V.; Gómez-López, M.; Stoddart, J. F. "Molecular Machines" Acc. Chem. Res. 1998, 31, 405-414: <doi>.
- Sauvage, J.-P. "Transition Metal-Containing Rotaxanes and Catenanes in Motion: Toward Molecular Machines and Motors" Acc. Chem. Res. 1998, 31, 611-619: <doi>.
- Balzani, V.; Credi, A.; Raymo, F. M.; Stoddart, J. F. "Künstliche molekulare Maschinen" Angew. Chem. 2000, 112, 3484-3530: <doi>.
- Kelly, T. R. "Progress toward a Rationally Designed Molecular Motor" Acc. Chem. Res. 2001, 34, 514-522: <doi>.
- Feringa, B. L. Acc. Chem. Res. 2001, 34, 504-513: <doi>.
- Jiménez-Molero, M. C.; Dietrich-Buchecker, C.; Sauvage, J.-P. "Towards Artificial Muscles at the Nanometric Level" Chem. Commun. 2003, 1613-1616: <doi>.
- Balzani, V.; Credi, A.; Silvi, S.; Venturi, M. "Artificial Nanomachines Based on Interlocked Molecular Species: Recent Advances" Chem. Soc. Rev. 2006, 35, 1135-1149: <doi>.
- Browne, W. R.; Feringa, B. L. "Making Molecular Machines Work" Nat. Nanotech. 2006, 1, 25-35: <doi>.
- Shirai, Y.; Morin, J.-F.; Sasaki, T.; Guerrero, J. M.; Tour, J. M. "Recent Progress on Nanovehicles" Chem. Soc. Rev. 2006, 35, 1043-1055: <doi>.
- Kay, E. R.; Leigh, D. A.; Zerbetto, F. "Synthetische molekulare Motoren und mechanische Maschinen" Angew. Chem. 2007, 119, 72-196: <doi>: <doi>.
- Vives, G.; Tour, J. M. "Synthesis of Single-Molecule Nanocars" Acc. Chem. Res. 2009, 42, 473-487: <doi>.
- von Delius, M.; Leigh, D. A. "Walking Molecules" Chem. Soc. Rev. 2011, 40, 3656-3676: <doi>.
- Erbas-Cakmak, S.; Leigh, D. A.; McTernan, C. T.; Nussbaumer, A. L. "Artificial Molecular Machines" Chem. Rev. 2015, 115, 10081-10206: <doi>.
Letzte Änderung: 23-03-30. Email

