Forschung - Cyclische Pseudopeptide
Ein cyclisches Pseudopeptid mit 1,5-disubstitutierten 1,2,3-Triazoluntereinheiten nimmt eine analoge Vorzugskonformation an wie das anionenbindende Cyclopeptid. Das Pseudopeptid bindet dementsprechend ebenfalls an anorganische Anionen und dies sogar in wässrigen Lösungsmittelgemischen.1 Dieses Pseudopeptid bildet jedoch in weniger ausgeprägtem Maße sandwich-artige 2:1 Komplexe.
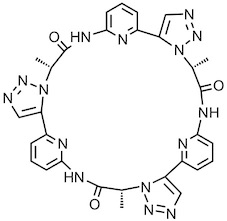
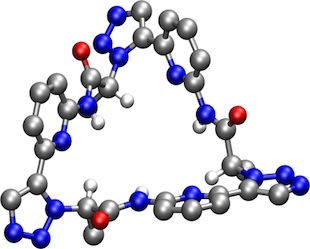
[Für eine interaktive Version der Kristallstruktur hier klicken]
Analoge cyclische Pseudopeptide mit 1,4-disubstituierten 1,2,3-Triazoleinheiten bevorzugen andere Konformationen, da diese Triazoleinheiten eher trans- and cis-Amiden ähneln. Durch die 1,4-disubstituierten Triazoleinheiten vergrößert sich außerdem der Ringdurchmesser im Vergleich zu dem Pseudopeptid mit 1,5-disubstituierten Triazolen und die Löslichkeit in wässrigen Lösungsmitteln sinkt.
Das unten abgebildete cyclische Trimer bindet Oxoanionen, wie Sulfat oder Dihydrogenphosphat, in 2.5 vol% Wasser/DMSO.2 Die Komplexe haben unterschiedliche Stöchiometrien, was zeigt, dass dieses Pseudopeptid keine für die Komplexbildung optimale strukturelle Komplementarität besitzt. Das nächst höhere Homologe, das cyclische Tetramer, zeigt eine besonders hohe Affinität für Dihydrogenphosphat- und Dihydrogenpyrophosphatanionen. Aufgrund der Größe des Pseudopeptids bilden sich aber keine 1:1 Komplexe. Im Falle von Dihydrogenpyrophosphatanionen werden zwei Anionen zwischen zwei Pseudopeptidringen gebunden und im Falle von Dihydrogenphosphat ein cyclisches Aggregat aus vier Anionen.3 Diese Komplexe sind so stabil, dass sie in Lösng und sogar in der Gasphase nachgewiesen werden können. Die Kristallstruktur des Dihydrogenphosphatkomplexes dieses Pseudopeptids ist unten abgebildet.
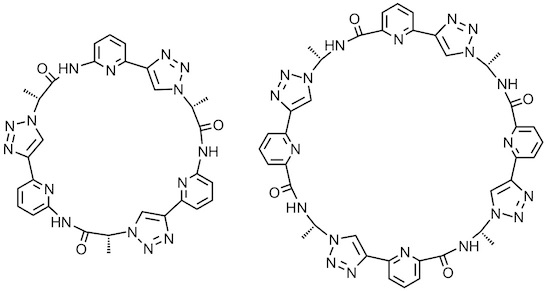
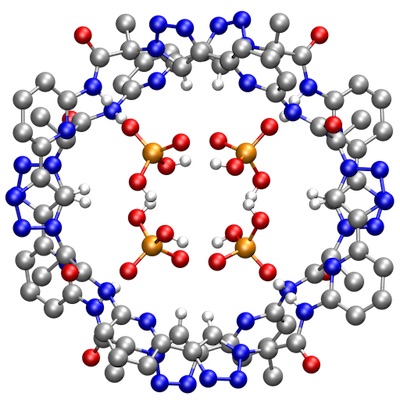
[Für eine interaktive Version der Kristallstruktur hier klicken]
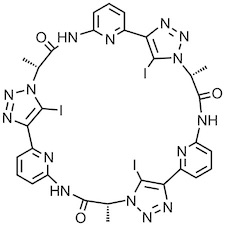
Das unten getzeigte cyclische Trimer mit 5-Iod-1,2,3-Triazoleinheiten besitzt einen kleineren Hohlraum als das analoge Pseudopeptid mit protonierten Triazoleinheiten. Es bindet darum vornehmlich an kleinere Halogenide, wobei die Komplexbildung auf Halogen-Wechselwirkungen beruht.4 Die höchste Affinität wird für Chloridanionen beobachtet.
Literatur
- M. R. Krause, R. Goddard, S. Kubik J. Org. Chem. 2011, 76, 7084-7095.
- D. Mungalpara, H. Kelm, A. Valkonen, K. Rissanen, S. Keller, S. Kubik Org. Biomol. Chem. 2017, 15, 102-113.
- D. Mungalpara, A. Valkonen, K. Rissanen, S. Kubik Chem. Sci. 2017, 8, 6005-6013.
- D. Mungalpara, S. Stegmüller, S. Kubik Chem. Commun. 2017, 53, 5095-5098.
Letzte Änderung: 23-03-09. Email

