Lehre - Supramolekulare Chemie - Catenane, Rotaxane, Knoten
Einleitung
Definitionen
In diesem Kapitel werden Vertreter von Verbindungen mit sogenannten mechanischen Bindungen vorgestellt. Man versteht darunter Verbindungen, die aus mehreren definierten Untereinheiten bestehen, welche untrennbar miteinander verbunden sind, obwohl sie nicht durch direkte Bindungen zusammengehalten werden. Die wichtigsten Beispiele für solche Verbindungen sind Rotaxane, Catenane und Knoten.
Solche Moleküle unterscheiden sich von vielen anderen organischen Molekülen durch ihre Topologie. Der Begriff Topologie stammt aus der Mathematik. Man versteht darunter Objekte, die durch kontinuierliche Veränderung ihrer Oberfläche ineinander überführt werden können. Danach sind eine Tasse und ein Ring topologisch äquivalent. Dies gilt ebenfalls für alle Moleküle, die durch planare Graphen dargestellt werden können.
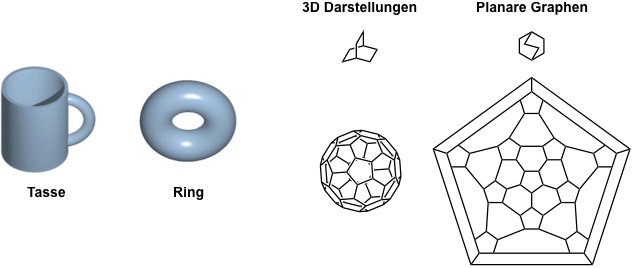
Moleküle, bei denen nach Projektion auf eine Ebene ein oder mehrere Kreuzungspunkte verbleiben, unterscheiden sich bezüglich ihrer Topologie von den obigen Beispielen. Die wichtigsten Beispiele solcher Moleküle sind Rotaxane, Catenane und Knoten.
Bei einem Rotaxan handelt es sich um ein Molekül, in dem ein Ring auf eine weitgehend stäbchenförmige Untereinheit, die Achse, aufgefädelt ist. Durch voluminöse Substituenten an den Enden der Achse wird das Abfädeln des Ringes verhindert. Pseudorotaxane sind Rotaxane ohne voluminöse Endgruppen. Diese Verbindungen sind nur im Gleichgewicht stabil, da ein Abfädeln des Ringes von der Achse noch möglich ist. Sie sind wichtige Vorstufen in Rotaxan- und Catenansynthesen.
Bei Catenanen handelt es sich um zwei oder mehrere miteinander verschlungene Ringe.
Ein Beispiel für einen Knoten ist der unten dargestellte sogenannte Kleeblattknoten.

Die Zahl in der eckigen Klammer gibt die Anzahl der Untereinheiten an. Ein [3]Rotaxan besteht dementsprechend aus einer Achse, auf die zwei Ringe aufgefädelt sind, oder aus einem Ring, der zwei Achsen beherbergt, während in einem [3]Catenan drei Ringe ineinander verschlungen sind.
Moleküle mit mechanischen Bindungen oder Knoten scheinen auf den ersten Blick nur von theoretischem Interesse zu sein. Jedoch wurden verschlungene Moleküle auch in der Natur beobachtet. So gibt es Catenane aus DNA (Catena-DNA) und knotenförmige Proteine.
Die Summenformeln von Catenanen oder Rotaxanen ergeben sich durch Addition der Summenformeln ihrer jeweiligen Untereinheiten. Demnach sind Verbindungen mit mechanischen Bindungen Isomere der nicht miteinander verbundenen einzelnen Komponenten. Bei Catenanen wird diese Form der Isomerie als topologische Isomerie bezeichnet, wobei topologische Isomere nicht ohne Bindungsbruch ineinander überführbar sind.
Unter der Annahme, dass der Ring und das [2]Catenan dieselben Summenformeln besitzen, handelt es sich um Konstitutionsisomere.

Unter der Annahme, dass der Ring und die Kleeblattknoten dieselben Summenformeln besitzen, handelt es sich um Konfigurationsisomere.

Topologische Enantiomerie setzt also nicht die Anwesenheit von stereogenen Zentren voraus.
Ein Rotaxan ist streng genommen kein topologisches Isomer zu den Komponenten, aus denen es aufgebaut ist, da in dem mathematischen Konzept der Topologie jede Linie unendlich dehnbar ist. Dadurch kann formal der Ring von der Achse eines Rotaxans gleiten auch wenn die Substituenten an den Enden der Achse sehr groß sind. In der Realität ist dies natürlich nicht möglich.
Die erste Synthese eines organischen Catenans gelang bereits 1960 E. Wasserman und Mitarbeitern. Dabei wurde die folgende, rein statistische Reaktionssequenz verwendet.
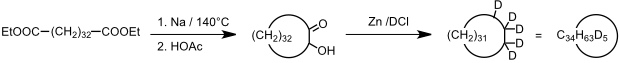
Im ersten Schritt wurde aus einem Dicarbonsäureester durch Acyloinkondensation und Clemmensen Reduktion mit Zn/DCl ein deuterierter cyclischer Kohlenwasserstoff synthetisiert, der laut Originalstelle "ca. 5 Deuteriumatome" enthält. Anschließend wurde derselbe Dicarbonsäureester in Anwesenheit eines 100fachen Überschusses dieses Makrocyclus unter den Bedingungen einer Acyloinkondensation zur Reaktion gebracht.
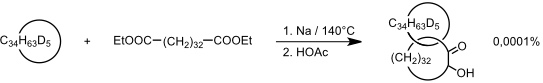
Dieses Beispiel verdeutlicht, dass der statistische Ansatz keine effiziente Methode der Catenansynthese darstellt. Es wurden daher in der Folgezeit Verfahren entwickelt, die in signifikant höheren Ausbeuten zu den gewünschten Produkten führen. So wurden in den 60er Jahren des 20. Jahrhunderts in den Gruppen um A. Lüttringhaus und G. Schill Catenan- und Rotaxansynthesen erarbeitet, bei denen eine Hilfsbindung, die am Ende der Synthese gespalten wird, die entsprechenden Untereinheiten zunächst zusammenhält. Dieser kovalente Ansatz ist allerdings synthetisch aufwendig und heute praktisch vollkommen von nicht-kovalenten (supramolekularen) Ansätzen verdrängt. Hierbei werden geeignete Rotaxan- bzw. Catenanvorstufen über nicht-kovalente Wechselwirkungen zunächst in räumlicher Nähe fixiert, bevor sie zur Reaktion gebracht werden. Als nicht-kovalente Wechselwirkungen spielen im Wesentlichen koordinative Wechselwirkungen, π-π Wechselwirkungen, Wasserstoffbrücken und hydrophobe Wechselwirkungen eine Rolle.
Literatur
- Amabilino, D. B.; Stoddart, J. F. "Interlocked and Intertwined Structures and Superstructures" Chem. Rev. 1995, 95, 2725-2828: <doi>.
- Raymo, F. M.; Stoddart, J. F. "Interlocked Macromolecules" Chem. Rev. 1999, 99, 1643-1666: <doi>.
- Breault, G. A.; Hunter, C. A.; Mayers, P. C. "Supramolecular Topology" Tetrahedron 1999, 55, 5265-5293: <doi>.
- Forgan, R. S.; Sauvage, J.-P.; Stoddart, J. F. "Chemical Topology: Complex Molecular Knots, Links, and Entanglements" Chem. Rev. 2011, 111, 5434-5464: <doi>.
- Gil-Ramírez, G.; Leigh, D. A.; Stephens, A. J. "Catenane: fünfzig Jahre molekulare Verschlingungen" Angew. Chem. 2015, 127, 6208-6249: <doi>.
Hilfsbindungen
Bei der von G. Schill 1964 beschriebenen gezielten Synthese eines Catenans wird zunächst in einer vielstufigen Sequenz ein Präcatenan dargestellt, das durch Spaltung von spezifischen Bindungen in das gewünschte Catenan überführt werden kann. Ausgangspunkt dieser Synthese ist ein cyclisches Brenzcatechinderivat, welches selber in einer achtstufigen Synthese hergestellt werden muss.
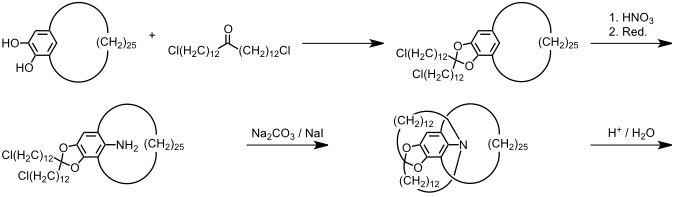
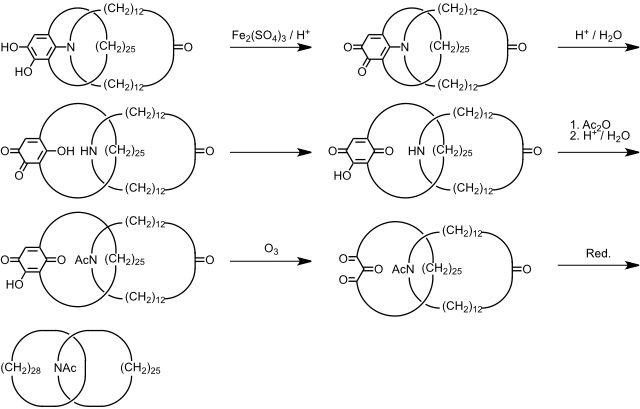
Das acetylierte Catenan ist ein kristalliner Feststoff, der vollständig charakterisiert werden konnte.
Schill gelang außerdem auf folgendem Weg die Synthese des ersten reinen Kohlenwasserstoffcatenans.
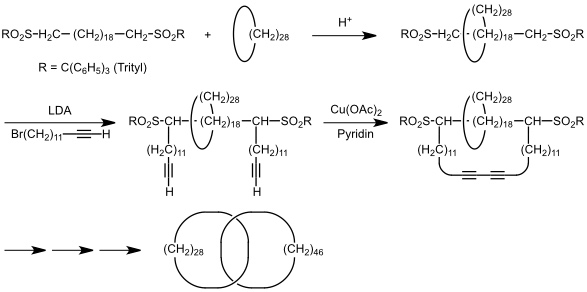
Auf analogem Weg wurden von Schill auch Rotaxane synthetisiert. Auch wenn diese Synthesen gezielt zu den gewünschten Produkten führen, ist die Ausbeute über alle Stufen aber insgesamt gering.
Literatur
- Schill, G.; Logemann, E.; Littke W. "Makrocyclen, Catenane, Knoten" Chem. unserer Zeit 1984, 18, 130-137: <doi>.
Metallkoordination
Synthese
Die Synthese eines Catenans unter Verwendung der Templateffekte von Metallen ist schematisch in der folgenden Abbildung gezeigt. Als primäres Produkt fällt ein Metallkomplex an, das sogenannte Catenat, welcher nach Demetallierung ein Catenan liefert.
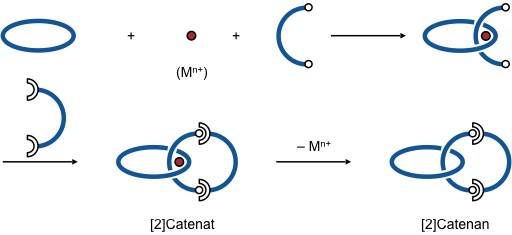
Bei dieser Strategie dient das Metall also als Templat zur Vororganisation der Catenanbausteine. Es erleichtert dadurch die Bildung des gewünschten Produkt, ohne an der eigentlichen Reaktion aber teilzunehmen. Wie bei Kronenethersynthesen kann man von einem kinetischen Templateffekt sprechen.
Dieser Typ der Catenansynthese wurde folgendermaßen realisiert.
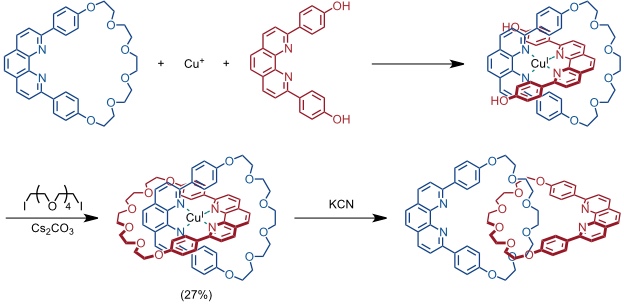
Auf eine vergleichbare Art und Weise kann auch ein [3]Catenan in praktikablen Ausbeuten dargestellt werden.
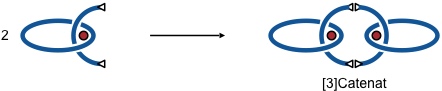
Als Ausgangsverbindung wurde in diesem Fall ein Cu(I) Komplex eingesetzt, in dem ein Ligand zwei terminale Dreifachbindungen enthält. Zwei Moleküle dieses Komplexes wurden intermolekular durch Glaser-Kupplung miteinander verknüpft.
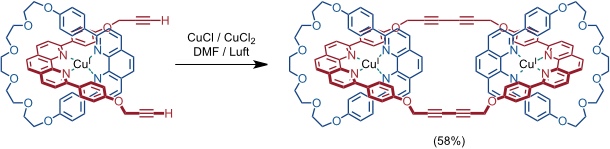
Als Nebenprodukt fiel bei dieser Reaktion ein [4]Catenat an.
Ein herausragendes Beispiel für die Anwendung von Metall-Ligand-Wechselwirkungen zur Synthese von verknäulten Strukturen ist die Darstellung einer Kleeblattknotenverbindung. Ausgangspunkt war in diesem Fall ein tetrafunktionalisierter, helixartiger Komplex (Helikat), der auf mehrere Arten cyclisiert werden kann.
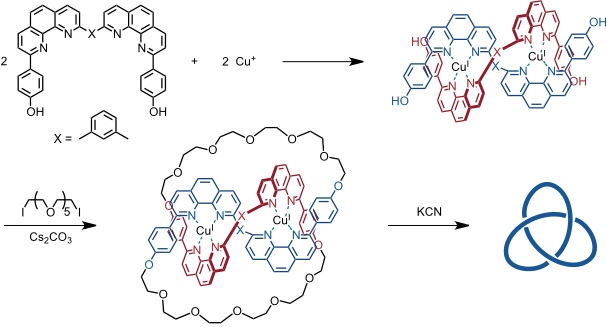
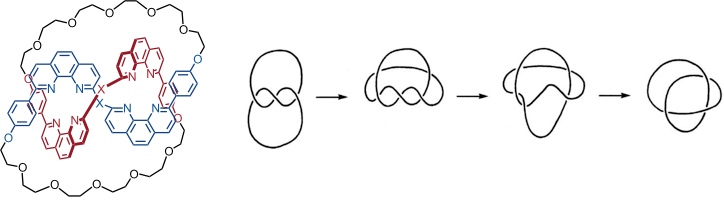
Die dargestellte Cyclisierung liefert einen Knoten. Werden andere Paare von OH-Gruppen miteinander verbunden, so entstehen außerdem ein Makrocyclus und ein Catenan.
Die Knotenstruktur wird dabei in einer Ausbeute von immerhin 30% erhalten und ist damit ohne weiteres in größeren Mengen zugänglich.
Da nur achirale Edukte verwendet werden, erhält man das Produkt als Racemat.
[Quelle: Dietrich-Buchecker, C. O.; Sauvage, J. P.; de Cian, A.; Fischer, J. J. Chem. Soc., Chem. Commun. 1994, 2231-2232: <doi>.]
Active Metal Template Strategie
Bei der active metal template Strategie, die in der Gruppe von Leigh entwickelt wurde, dient das Metall nicht nur zur Vororganisation der Catenan bzw. Rotaxanbausteile, es katalysiert darüber hinaus unmittelbar die Bildung einer Bindung, welche zum Produkt führt, z.B. die Bildung der Rotaxanachse innerhalb eines Ringes. Dieses Konzept kann schematisch folgendermaßen dargestellt werden.
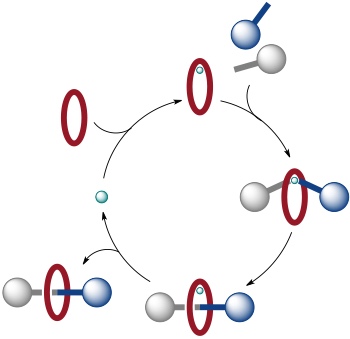
Auch bei dieser Synthesestrategie stellt das Metall ein kinetisches Templat dar, allerdings übernimmt es zwei Rollen: es führt zur Vororganisation der Bindungspartner und es katalysiert die gewünschte Reaktion.
Vorteile im Vergleich zu der von Sauvage entwickelten passive metal template Strategie sind:
- keine Notwendigkeit der Anwesenheit spezifischer Koordinationsstellen in beiden Rotaxan- bzw. Catenankomponenten,
- das Metall muss nicht in stöchiometrischen Mengen zugesetzt werden.
Die erste Anwendung fand die active metal template Strategie in der Synthese eines Rotaxans, bei der die beiden Achsenkomponenten mittels Kupfer(I)-katalysierter Azid-Alkin-Cycloaddition miteinander verknüpft wurden.
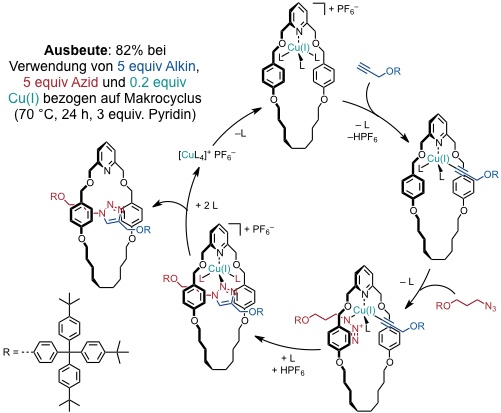
Andere Übergangsmetall-katalysierte Reaktionen, die entsprechend für Rotaxan- oder Catenansynthesen eingesetzt wurden, sind:
- Glaser Kupplung,
- Cadiot-Chodkiewicz-Kupplung,
- Heck Reaktion,
- Palladium-katalysierte oxidative Kupplung terminaler Alkine.
Borromäische Ringe
Auch thermodynamische Templateffekte können für die Synthese von Verbindungen mit mechanischen Bindungen ausgenutzt werden. Bei der folgenden Synthese wird aus sechs Komponenten in einem Schritt ein Produkt gebildet, das die Topologie Borromäischer Ringe besitzt. Die Zinkatome stabilisieren in diesem Fall das Produkt, welches aufgrund der Reversibilität der Iminbildung unter thermodynamischen Bedingungen zum Hauptprodukt wird.
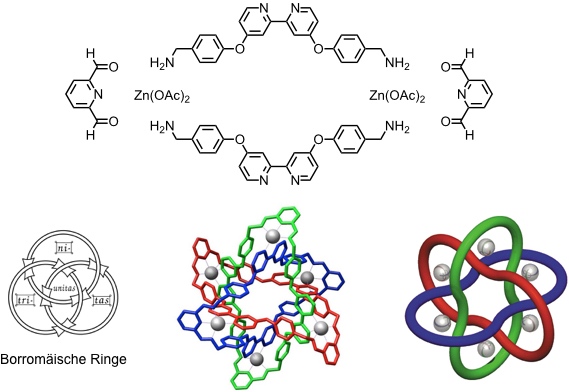
[Quelle: Chichak, K. S.; Cantrill, S. J.; Pease, A. R.; Chiu, S.-H.; Cave, G. W. V.; Atwood, J. L.; Stoddart, J. F. Science 2004, 304, 1308-1312: <doi>.]
Literatur
- Dietrich-Buchecker, C. O.; Sauvage, J. P. "Interlocking of Molecular Threads: From the Statistical Approach to the Templated Synthesis of Catenands" Chem. Rev. 1987, 87, 795-810: <doi>.
- Crowley, J. D.; Goldup, S. M.; Lee, A.-L.; Leigh, D. A.; McBurney, R. T. "Active Metal Template Synthesis of Rotaxanes, Catenanes and Molecular Shuttles" Chem. Soc. Rev. 2009, 38, 1530-1541: <doi>.
Charge-Transfer
Konzept
Die Arbeitsgruppe um J. F. Stoddart hat maßgebliche Beiträge zur Catenan- und Rotaxansynthese unter Nutzung der Wechselwirkungen zwischen elektronenreichen und elektronenarmen Aromaten geleistet. Ausgangspunkt war die Beobachtung, dass ein Paraquat Dikation einen Komplex mit Bis(para-phenylen)[34]krone-10 bildet.
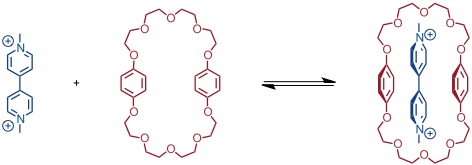
Dieser Komplex wird durch verschiedene Wechselwirkungsarten – darunter CH···O Wasserstoffbrücken zwischen Wasserstoffatomen des Paraquats und Polyethersauerstoffatomen – stabilisiert. Aufgrund der Charge-Transfer Wechselwirkungen der aromatischen Systeme in Wirt und Gast ist der Komplex tief orange.
Umgekehrt kann ein elektronenreicher Aromat, z.B. Hydrochinondimethylether, durch ein tetrakationisches Cyclophan mit zwei Paraquatuntereinheiten komplexiert werden.
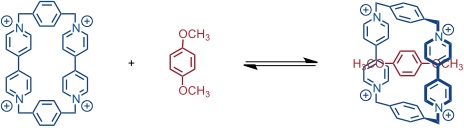
Dieser Komplex wird ausschließlich durch die aromatischen Wechselwirkungen zusammengehalten, was sich in einer geringeren Stabilitätskonstante im Vergleich zum ersten Komplex äußert (17 M-1 im Vergleich zu 730 M-1).
Synthese
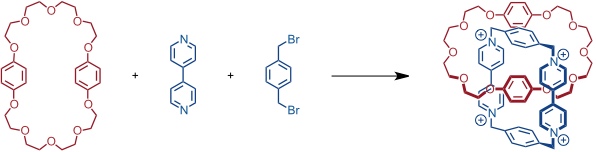
Ausgehend von diesen Beobachtungen wurde eine [2]Catenansynthese realisiert, bei der ein Ring mit Paraquatuntereinheiten auf einen mit Hydrochinonuntereinheiten aufgefädelt wird.
Mechanistisch verläuft diese Reaktion wahrscheinlich über einen offenkettigen Vorläufer des Cyclophans. Dieser cyclisiert in Abwesenheit des Kronenethers schlecht. Werden die aromatischen Untereinheiten aber durch Bindung an den Kronenether vororganisiert, so wird eine Anordnung stabilisiert, die für einen Ringschluss optimal geeignet ist. Diese Vorstellung erklärt die hohe Ausbeute von 70% (!).
Dynamik
Das entstehende Catenan ist eine dynamische Verbindung, was durch temperaturabhängige NMR-Spektroskopie gezeigt werden konnte. Dabei wurden drei Arten von dynamischen Prozessen nachgewiesen.
Der neutrale Makrocyclus rotiert um die innen liegende Bipyridiniumeinheit. Da dabei alle nicht-kovalenten Wechselwirkungen im [2]Catenan aufgehoben werden müssen, weist dieser Prozess eine relativ hohe Energiebarriere auf und findet bei 25 °C nur 22 mal pro Sekunde statt.
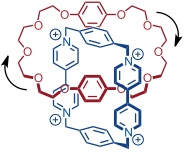
Ein Hydrochinonring wandert in Form einer Pirouettenbewegung entlang der Peripherie des Tetrakations. Da dabei nur an einer Stelle Wechselwirkungen zwischen den aromatischen Systemen aufgehoben werden, hat dieser Prozess eine geringere Energiebarriere und findet bei 25 °C 7000 mal pro Sekunde statt.
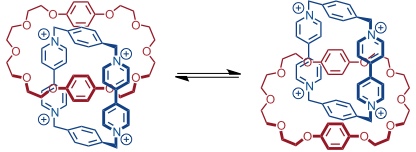
Der Hydrochinonring schaukelt hin und her. Bei 25 °C findet diese Bewegung 1,6 · 106 mal statt.
Olympiadan
Die Vergrößerung eines Ringes, z.B. des Kronenethers, ermöglicht die Synthese von Catenanen mit mehr als zwei Komponenten. So führt die Umsetzung des folgenden Kronenethers mit 4,4‘-Bipyridin und 1,4-Bis(brommethyl)benzol in 12%iger Ausbeute zunächst ebenfalls zum [2]Catenan.
![[2]Catenansynthese](img/oc9/cat_cha_06.jpg)
Die dynamischen Prozesse, die für das kleinere Catenan charakteristisch sind, treten auch bei dieser Verbindung auf. Die Pirouettenbewegung entlang der Peripherie des Bis(paraquat)rings besitzt wegen des größeren Hohlraums allerdings eine sehr viel niedrigere Energiebarriere und findet 28000 mal pro Sekunde statt.
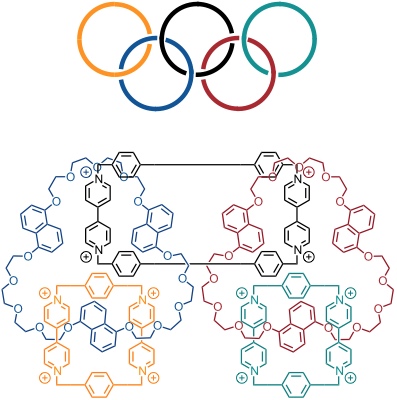
Aufbauend auf dieser Strategie konnten dann auch über das [2]Catenan hinaus größere Systeme gezielt synthetisiert werden, z.B. ein beeindruckendes [5]Catenan, dessen Struktur an die olympischen Ringe erinnert und dass aus diesem Grund auch Olymiadan genannt wurde.
Rotaxane
Die Wechselwirkung komplementärer π-Donatoren und π-Akzeptoren lässt sich auch zur Synthese von Rotaxanen ausnutzen, wobei man bei Rotaxansynthesen zwischen der Auffädelungsmethode (threading) und dem Klammerverfahren (clipping) unterscheidet.
Beim threading wird ein Pseudorotaxan mit geeigneten funktionellen Gruppen an den beiden Enden der Achse durch Anknüpfung voluminöser Substituenten in ein Rotaxan überführt.
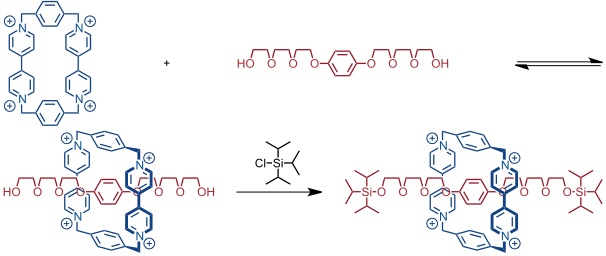
Beim clipping wird der Bis(paraquat)ring um die vorgebildete Achse aufgebaut.

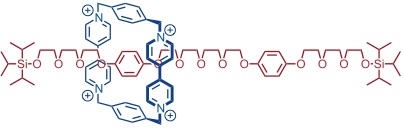
Bei Verlängerung der Achse und Einbau mehrerer Stationen für den Bis(paraquat)ring kommt man zu sogenannten Molekularen Shuttles. In folgendem Rotaxan pendelt der Bis(paraquat)ring bei Raumtemperatur beispielsweise 1800 mal pro Sekunde hin und her. Bei -50 °C kommt der Positionswechsel zum Stillstand, so dass die beiden Hydrochinonringe im NMR unterscheidbar werden.
Weitere Beispiele von molekularen Shuttles und verwandten Systemen, in denen die Position des Rings auf der Achse und seine Bewegung gezielt kontrolliert werden kann, werden im Kapitel Molekulare Maschinen vorgestellt.
Literatur
- Philp, D.; Stoddart, J. F. "Selbstorganisation in natürlichen und in nichtnatürlichen Systemen" Angew. Chem. 1996, 108, 1242-1286: <doi>.
Wasserstoffbrücken
Synthese
Eine der einfachsten Catenansynthesen beschrieben 1995 D. A. Leigh und Mitarbeiter. Danach führt die Umsetzung der käuflichen Edukte Isophthalsäuredichlorid und 1,4-Bis(aminomethyl)benzol unter Verdünnungsbedingungen in einer 20%igen Ausbeute zum entsprechenden [2]Catenan, welches aufgrund seiner Unlöslichkeit im verwendeten Lösungsmittel aus der Reaktionslösung ausfällt und durch einfache Filtration isoliert werden kann.
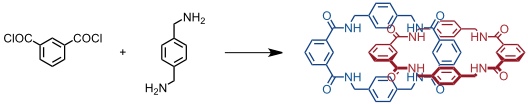
Man nimmt an, nach Bildung eines Rings ein eine noch offenkettige Vorstufe auf den Ring auffädelt, wodurch eine stabilisierende Wechselwirkung zwischen den Amidgruppen möglich wird. Dieses durch Wasserstoffbrücken stabilisierte Pseudorotaxan reagiert anschließend zum Catenan.
[Quelle: Johnston, A. G.; Leigh, D. A.; Nezhat, L.; Smart, J. P.; Deegan, M. D. Angew. Chem. 1995, 107, 1324-1327: <doi>.]
Auf analogem Weg verläuft die 1991 von C. A. Hunter beschriebene Catenansynthese bei der eigentlich ein Makrocyclus zur Komplexierung von p-Benzochinon synthetisiert werden sollte.
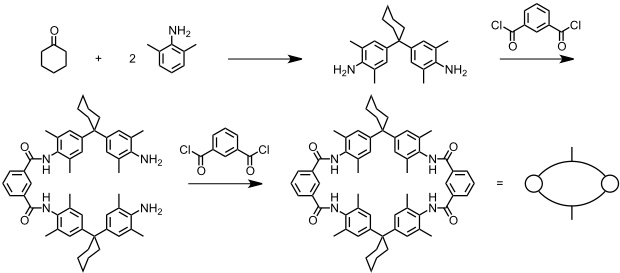
[Quelle: Hunter, C. A. J. Am. Chem. Soc. 1992, 114, 5303-5311: <doi>.]
Überraschenderweise fiel bei dieser Reaktion neben dem gewünschten Produkt und einem entsprechenden Tetramer in signifikanten Mengen das unten schematisch dargestellte eine [2]Catenan an.
In der Folgezeit hat sich vor allem die Gruppe um F. Vögtle mit der Synthese von strukturverwandten Catenanen und Rotaxanen beschäftigt. So wurde der Bildungsmechanismus solcher Catenane systematisch studiert.
Stereoisomerie
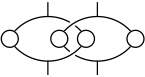
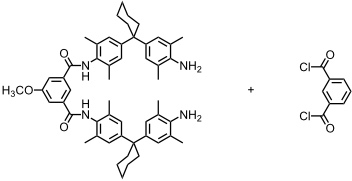
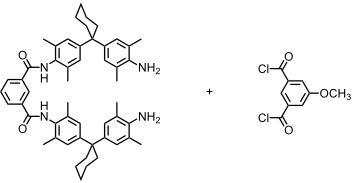
Verwendet man bei der Synthese des Catenans ein substituiertes und ein unsubstituiertes Isophthaloylderivat, sind drei isomere Produkte denkbar.
Durch die sperrigen Cyclohexylsubstituenten wird eine Rotation der Ringe verhindert, sodass sich die Isomere nicht ineinander umwandeln können. Bei den folgenden Synthesen beobachtet man aber immer zur zwei der drei möglichen Produkte.
Fall I
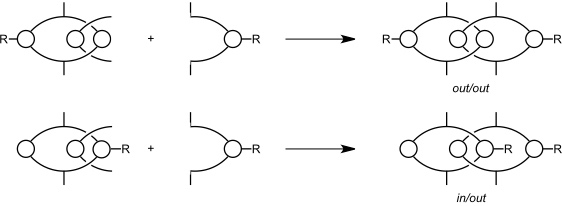
Fall II
Das jeweils dritte mögliche Isomer entsteht nicht. Damit wäre gezeigt, das es bei der Catenanbildung zunächst zu einem Auffädeln des Isophthaloyldichlorids auf einen bereits gebildeten Makrocyclus kommt. Das entstehende Pseudorotaxan ist durch Wasserstoffbrücken zwischen den C=O und den NH-Gruppen stabilisiert.
Ein Auffädeln der Diaminoeinheit auf einen Ring ist aus sterischen Gründen nicht möglich. Außerdem scheinen zwei offenkettige Vorstufen ebenfalls nicht miteinander zu wechselwirken.
Wasserstoffbrücken als stabilisierende Wechselwirkungen zwischen den C=O und NH Gruppen wurden in Kristallstrukturen der Catenane tatsächlich nachgewiesen.
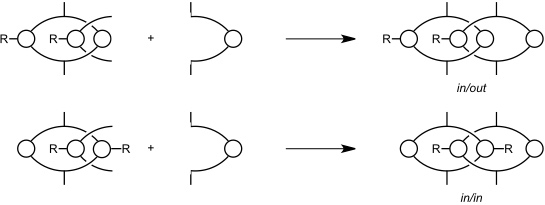
Ein weiteres Indiz für das Vorliegen der postulierten Pseudorotaxane als Zwischenprodukte ist die Produktverteilung bei der Reaktion zwischen Isophthaloyldichlorid und einem Diamin mit einer Sulfonamidgruppe.
Fall III
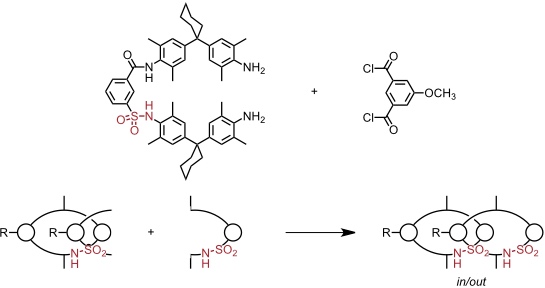
Von den beiden möglichen Produkten (in/out und in/in) bildet sich nur das in/out Isomer, da Sulfonamide stabilere Wasserstoffbrücken zu C=O Gruppen ausbilden als Amide und dadurch die Orientierung der Achse im Pseudorotaxan festgelegt ist.
In Abhängigkeit der Orientierung der Sulfonamidgruppe liegt das in/out Catenan in zwei stereoisomeren Formen vor, die sich wie Bild und Spiegelbild verhalten.
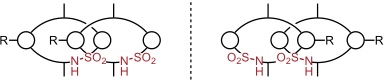
Dies ist also ein weiteres Beispiel für topologische Chiralität, bei der die Bausteine des Catenans selber achiral sind, ihre räumliche Anordnung jedoch zu einer chiralen Struktur führt.
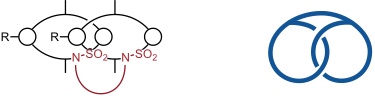
Wegen ihrer im Vergleich zu Carbonsäureamiden größeren Acidität können Sulfonamide in Gegenwart von Carbonsäureamiden am NH deprotoniert werden. Die Reaktion des entsprechenden doppelt deprotonierten [2]Catenans führt zu einem verbrückten Derivat mit der Topologie eines Brezels (Pretzelane).
Knoten
Ausgehend von strukturell verwandten Bausteinen wurde in der Gruppe von F. Vögtle die einstufige Synthese eines molekularen Knotens realisiert.
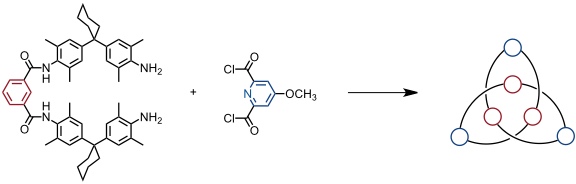
[Quelle: Safarowsky, O.; Nieger, M.; Fröhlich, R.; Vögtle, F. Angew. Chem. 2000, 112, 1699-1701: <doi>.]
Da bei der Synthese nur achirale Edukte eingesetzt wurden, fiel das Produkt als Racemat an. Eine Trennung der Enantiomeren war allerdings mittels Chromatographie auf einer chiralen stationären Phase möglich. Der Bildungsmechanismus dieses Knotens ist komplex und wurde in der Gruppe von F. Vögtle im Detail studiert.
[Quelle: Brüggemann, J.; Bitter, S.; Müller, S.; Müller, W. M.; Müller, U.; Maier, N. M.; Lindner, W.; Vögtle, F. Angew. Chem. 2007, 119, 258-263: <doi>.]
Eine enantioselektive einstufige Synthese eines Kleeblattknotens gelang in der Gruppe von M. Feigel ausgehend von folgendem Baustein.
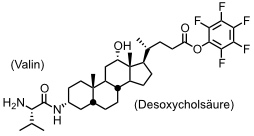
Bei der Cyclisierung dieser Verbindung erhält man neben einem makrocyclischen Trimer (32%) in 21%iger Ausbeute ein Hexamer, dessen Kristallstrukturanalyse zeigt, dass es eine knotenförmige Struktur besitzt.
[Quelle: Feigel, M.; Ladberg, R.; Engels, S.; Herbst-Irmer, R.; Fröhlich, R. Angew. Chem. 2006, 118, 5827-5831: <doi>.]
Rotaxane
Analog zur Vorgehensweise bei der Synthese von Catenanen können mit Hilfe der von Vögtle entwickelten Strategie auf einfache Weise auch Rotaxane in guten Ausbeuten dargestellt werden.
![[3]Rotaxansynthese](img/oc9/cat_hbr_14.jpg)
Bei dieser Reaktion wird zunächst wiederum das Isophthaloyldichlorid im Makrocyclus gebunden. Anschließend reagieren die beiden Säurechloridgruppen mit den Aminogruppen des Stoppers. Diese Strategie der Rotaxansynthese kann somit als threading klassifiziert werden.
Die Variationsbreite der Disäurechloride, welche als Achse des Rotaxans eingesetzt werden können, ist sehr groß. Ebenso können die Stopper des Rotaxans strukturell verändert werden.
Bei Verwendung einer Achse, auf der zwei Ringe Platz finden, kann man [3]Rotaxane erhalten.
![[3]Rotaxansynthese](img/oc9/cat_hbr_15.jpg)
Bei der Synthese dieses [3]Rotaxans aus den Komponenten entsteht als Nebenprodukt das entsprechende [2]Rotaxan. Darin ist ein Komplexierungsort für den Ring unbesetzt. Der Platzwechsel des Rings auf den beiden Stationen der Achse ist aber so schnell, dass er auch bei -60 °C nicht eingefroren werden kann.
Trapping
Neben dem threading wurde in der Gruppe von Vögtle eine zweite Strategie zur Synthese von Rotaxanen verwendet. Diese basiert auf der Beobachtung, dass Phenolatanionen in aprotischen Lösungsmitteln an die NH-Gruppen des makrocyclischen Tetralactams binden. Die Phenolate bleiben auch nach der Komplexbildung nucleophil, aufgrund der Geometrie des Komplexes kann die Reaktion mit einem Elektrophil aber nur von der Gegenseite des Ringes erfolgen.
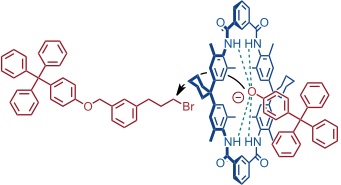
Da bei dieser Reaktion die beiden Komponenten der Achse gewissermaßen im Makrocyclus eingefangen werden, wurde für diese Art der Rotaxansynthese der Begriff trapping gewählt.
Diese Rotaxansynthese kann mit beachtlichen Ausbeuten von bis zu 95% ablaufen. Als Templat fungiert das Phenolation. Dabei ist zu beachten, dass im Gegensatz zu Metallkationen, die ebenfalls als Template in Rotaxan- und Catenansynthesen fungieren können, in diesem Fall das Templat nach der Reaktion Bestandteil des Produkts ist.
Stereoisomerie bei Rotaxanen
In der Gruppe von Vögtle wurden auch Rotaxane synthetisiert, die Sulfonamidgruppen im Ring und in der Achse enthalten. Solche Verbindungen sind, ähnlich wie die entsprechenden Catenane, chiral.
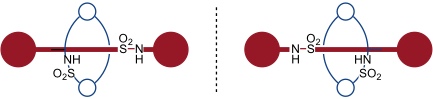
Durch Verbrückung der Sulfonamide kommt man zu [1]Rotaxanen mit interessanter Topologie.
![[1]Rotaxan](img/oc9/cat_hbr_18.jpg)
Außerdem sind eine Vielfalt weiterer Catenane, Rotaxane und verbrückter Derivate in der Gruppe von F. Vögtle dargestellt worden. Die Präorganisation der Ausgangskomponenten mit Hilfe von Wasserstoffbrücken ist also eine leistungsfähige Strategie zur Synthese solcher Verbindungen.
Literatur
- Jäger, R.; Vögtle, F. "Eine neue Synthesestrategie für Moleküle mit mechanischen Bindungen: nichtionische Templatsynthese amidverknüpfter Catenane und Rotaxane" Angew. Chem. 1997, 109, 966-980: <doi>.
- Seel, C.; Vögtle, F. "Templates, 'Wheeled Reagents', and a New Route to Rotaxanes by Anion Complexation: The Trapping Method" Chem. Eur. J. 2000, 6, 21-24: <doi>.
Hydrophobe Effekte
Rotaxane
Hydrophobe Wechselwirkungen werden ausgenutzt, um Rotaxane oder Catenane mit Cyclodextrineinheiten herzustellen. Dabei stellen die Cyclodextrine bereits vorgefertigte Ringe dar, durch deren Hohlraum die zweite Komponente durchgefädelt wird. Wird das Abfädeln durch Anbringen von voluminösen Substituenten an den beiden Endes des im Cyclodextrinhohlraum eingelagerten Moleküls verhindert, erhält man ein Rotaxan; die Cyclisierung des Gastes liefert ein Catenan. In beiden Fällen kann die Synthese als threading bezeichnet werden.
Isnin und Kaifer beschrieben die Synthese eines [2]Rotaxans, das einen α-Cyclodextrinring enthält. Hierzu wurde ein Alkyl(ferrocenylethyl)dimethylammoniumsalz mit α-Cyclodextrin komplexiert. Die Ferrocenyleinheit dient als Stopper, während die freie Carboxylgruppe am anderen Ende des Substrats nach Komplexbildung aus dem Hohlraum des Cyclodextrins herausragt. Die Reaktion mit Kalium-5-amino-2-naphthalinsulfonat in Anwesenheit eines geeigneten Kupplungsreagenzes führt zu dem zwitterionischen Produkt.
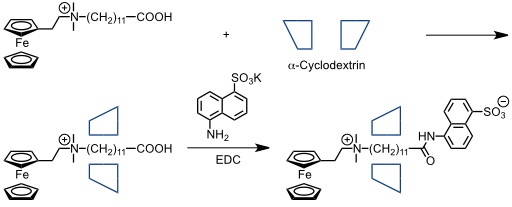
[Quelle: Isnin, R.; Kaifer, A. E. J. Am. Chem. Soc. 1991, 113, 8188-8190: <doi>.]
Wenz und Mitarbeiter verwendeten anstelle eines hydrophilen Cyclodextrins, das ein hydrophobes Gastmolekül bindet, ein lipophiles, das in inerten Lösungsmitteln kationische Gastmoleküle komplexieren kann. Sie gelangten so zu einem weitgehend lipophilen [2]Rotaxan.
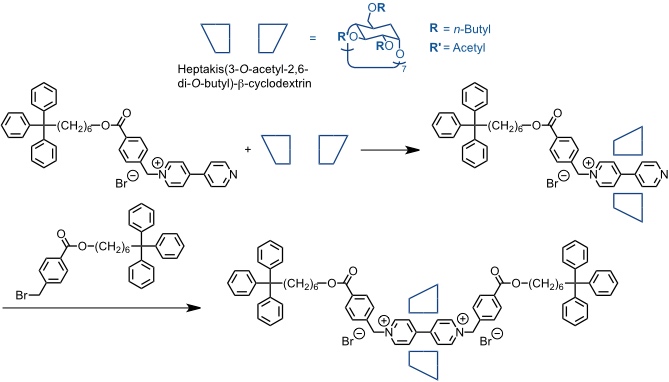
[Quelle: Wenz, G.; Wolf, F.; Wagner, M.; Kubik, S. New J. Chem. 1993, 17, 729-738.]
Polyrotaxane
Auch Polyrotaxane mit Cyclodextrinen sind beschrieben worden. So erhält man durch Auffädeln von α-Cyclodextrin auf eine Polyethylenglycolkette mit zwei terminalen Aminogruppen ein Pseudopolyrotaxan, welches durch Reaktion mit Sangers-Reagenz in das entsprechende Polyrotaxan überführt werden kann.
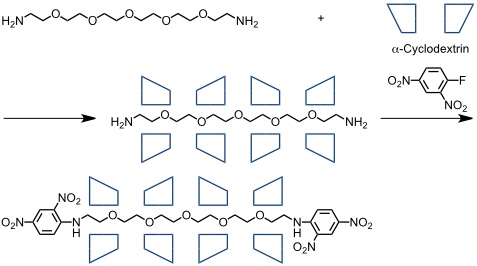
Durch intermolekulare Vernetzung der Cyclodextrine mit Epichlorhydrin und anschließendes Abfädeln des Polyethylenglycols gelangte Harada zu einem röhrenförmigen oligomeren Cyclodextrinderivat (Nanotube).
[Quelle: Harada, A.; Li, J.; Kamachi, M. J. Am. Chem. Soc. 1994, 116, 3192-3196: <doi>.]
Im Arbeitskreis von Wenz wurden Cyclodextrine auf Polyethylenimin aufgefädelt. Das Abfädeln wurde durch Reaktion des Polymers mit Nicotinsäurechlorid verhindert. Die Stopper sind in diesem Polyrotaxan statistisch über die Kette verteilt.
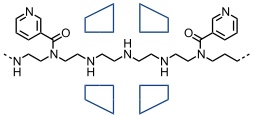
[Quelle: Wenz, G.; Keller, B. Angew. Chem. 1992, 104, 201-204: <doi>.]
Seitenkettenrotaxane mit einer Tandemstruktur aus Cyclodextrinen und einer Polymethacrylathauptkette wurden im Arbeitskreis von H. Ritter entwickelt.
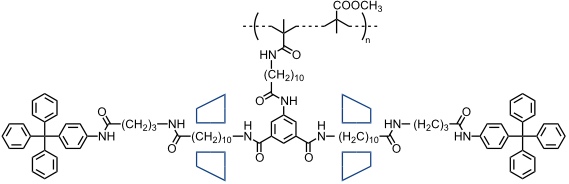
[Quelle: Born, M.; Ritter, H. Angew. Chem. 1995, 107, 342-344: <doi>.]
Catenane
Eine Synthese von [2]Catenanen auf Basis von Cyclodextrinen gelang in der Gruppe von J. F. Stoddart.
![Cyclodextrin[2]catenan](img/oc9/cat_hyd_06.jpg)
Die isomeren [3]Catenane werden als äquimolares Gemisch mit einer Ausbeute von 1,1% gebildet.
![Cyclodextrin[3]catenane](img/oc9/cat_hyd_07.jpg)
Eine Vielzahl weiterer Rotaxane und Catenane mit Cyclodextrineinheiten sind beschrieben worden. Struktur und Synthese sind bei den meisten Verbindungen aber vergleichbar.
Literatur
Letzte Änderung: 23-03-30. Email

